第四单元 研究型实验 知识点题库

-
(1) 甲同学欲比较N、C、Si的非金属性强弱,设计了图1所示的实验装置,其设计的依据是;但该装置存在缺陷,请指出.
-
(2) 乙同学设计了如图2装置验证元素性质递变规律.A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸.乙同学可能观察到的现象A.;B.;C..从环保角度考虑,该装置有明显不足,请指出提出改进建议.

-
(1) 在实验中,A部分的装置是(填图2中字母序号),写出A中发生的离子化学方程式.
-
(2) ①装置B中盛放的试剂名称为,作用是
②装置D和E中出现的不同现象说明了
③装置F的作用是
④写出装置G中发生反应的离子方程式
-
(3) 乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置.你认为该装置应加在与之间(填装置字母序号),装置中应放入试剂(填写试剂或用品名称).

-
(1) 实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是.
-
(2) 在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是.
再由a向c中加2mL蒸馏水,c中的实验现象是.
-
(3) 如表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是,理由是、.
方 案
反 应 物
甲
Cu、浓HNO3
乙
Cu、稀HNO3
丙
Cu、O2、稀HNO3
-
(4) 该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2 . 操作步骤为:实验现象为.

-
(1) 能证明氯水具有漂白性的是(填“a”“b”“c”“d”或“e”)。
-
(2) 反应c过程中的现象是,反应e的化学方程式为,反应b的化学方程式为。
-
(3) 久置的氯水最终会变成,用化学反应方程式表示为。
-
(4) 实验室保存氯水的方法是。
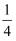 C . 将水蒸气通过灼热的铁粉,铁与水在高温下反应粉末变红
D . 将一定量的铁、铜的混合物加入100mL0.1mol·L-1的FeCl3溶液中,充分反应后溶液中有固体剩余,则剩余的固体中可能含有铜,也可能含有铁
C . 将水蒸气通过灼热的铁粉,铁与水在高温下反应粉末变红
D . 将一定量的铁、铜的混合物加入100mL0.1mol·L-1的FeCl3溶液中,充分反应后溶液中有固体剩余,则剩余的固体中可能含有铜,也可能含有铁

已知:乙醚[(C2H5)2O]沸点34.5℃,易挥发、易燃、低毒,挥发后点燃易发生爆炸,微溶于水,密度比水小。含Fe3+的HCl溶液,在HCl浓度较高时,用3倍体积的含HCl的乙醚溶液萃取,可形成易溶于乙醚的缔合物[(C2H5)2O·H]+·[FeCl4]-;降低HCl浓度,该缔合物解离。请回答:
-
(1) 经操作A可得溶液Ⅰ、Ⅱ,具体操作为:静置后,。
-
(2) 适量加入的试剂甲,最好是难溶性还原剂,原因是。
-
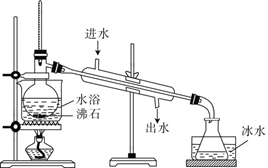
(3) 蒸馏装置如图所示,装置中存在的不正确是、。
-
(4) 下列有关说法错误的是。
A 滴定管在使用前需用待装液润洗,锥形瓶则不用润洗
B 判断经操作A后,Fe3+是否有残留,可以使用KSCN溶液检测
C 开始滴定前,滴定管尖嘴处悬有标准液液滴,滴定终点时尖嘴处无悬液,则测得的Fe3+浓度偏高
D 溶液由黄色变为浅紫色时,滴定到达终点
-
(5) 先除去溶液中溶解的HCl,再用0.0500mol·L-1 KMnO4溶液进行滴定,实验三次,达到终点时平均消耗KMnO4溶液12.00 mL。根据该实验数据,试样X中c(Fe3+)为。
| 选项 | 性质 | 用途 |
| A | | 纯碱是除污粉的成分之一 |
| B | | |
| C | 过氧化氢是强氧化剂 | 实验室以过氧化氢为原料制备 |
| D | | 用 |
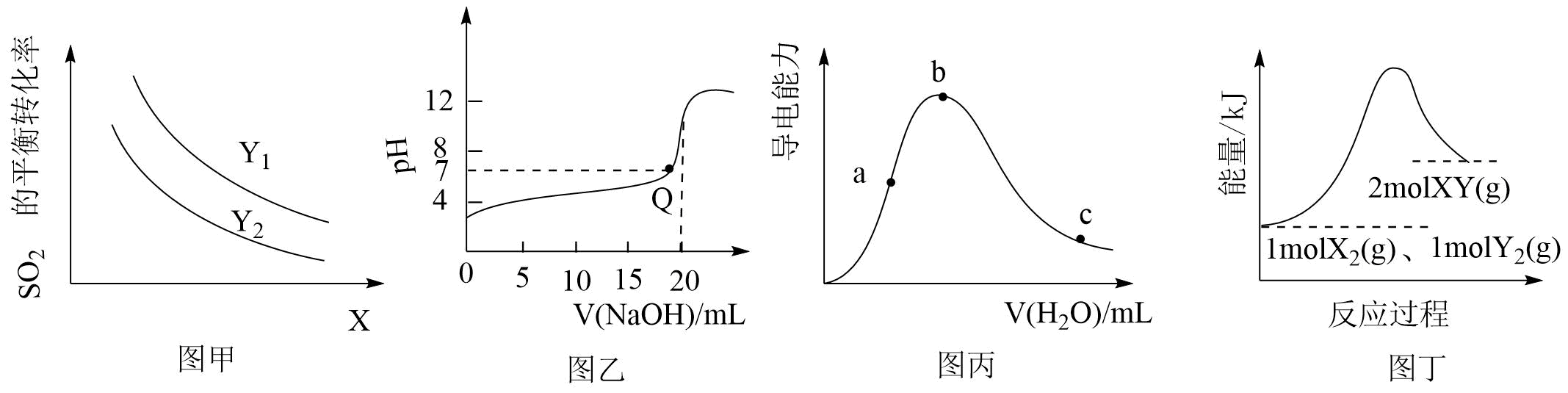
 中
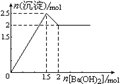
中 的平衡转化率随温度、压强的变化曲线,说明X代表温度,Y代表压强,且
的平衡转化率随温度、压强的变化曲线,说明X代表温度,Y代表压强,且 B . 图乙是常温下用
B . 图乙是常温下用 溶液滴定
溶液滴定 溶液的滴定曲线,说明Q点表示酸碱中和滴定终点
C . 图丙是室温下稀释冰醋酸时溶液的导电能力随加入水的体积的变化曲线,说明醋酸的电离程度:
溶液的滴定曲线,说明Q点表示酸碱中和滴定终点
C . 图丙是室温下稀释冰醋酸时溶液的导电能力随加入水的体积的变化曲线,说明醋酸的电离程度: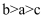 D . 图丁是
D . 图丁是 、
、 反应生成
反应生成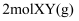 的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和
的能量变化曲线,说明反应物所含化学键的键能总和小于生成物所含化学键的键能总和
已知:
i.(NH4)2S2O8具有强氧化性,能完全电离,S2O 易被还原为SO
易被还原为SO ;
;
ii.淀粉检测I2的灵敏度很高,遇低浓度的I2即可快速变蓝;
iii.I2可与S2O 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O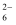 +2I-。
+2I-。
|
编号 |
1-1 |
1-2 |
|
实验操作 |
|
|
|
现象 |
无明显现象 |
溶液立即变蓝 |
-
(1) 实验1-1的目的是。
-
(2) (NH4)2S2O8与KI反应的离子方程式为。
为了研究(NH4)2S2O8与KI反应的速率,小组同学分别向两支试管中依次加入下列试剂,并记录变色时间,如表。
编号
0.2mol·L-1KI溶液/mL
0.01mol·L-1Na2S2O3溶液/mL
蒸馏水/mL
0.4%的淀
粉溶液/滴
0.2mol·L-1(NH4)2S2O8溶液/mL
变色时间/s
2-1
2
0
2.8
2
0.2
立即
2-2
2
0.8
0.2
2
2
30
-
(3) 实验2-1不能用于测定(NH4)2S2O8与KI反应的速率,原因除变色时间过短外还有。
-
(4) 加入Na2S2O3溶液后溶液变蓝的时间明显增长,甲同学对此提出两种猜想。
猜想1:(NH4)2S2O8先与Na2S2O3反应,使c(S2O
 )降低;
)降低;猜想2:(NH4)2S2O8先与KI反应,..............。
①甲同学提出猜想1的依据:由信息iii推测,Na2S2O3的还原性(填“强于”或“弱于”)KI的。
②乙同学根据现有数据证明猜想1不成立,理由是。
③补全猜想2:。
-
(5) 查阅文献表明猜想2成立。根据实验2-2的数据,计算30s内的平均反应速率v(S2O
 )=mol·L-1·s-1(写出计算式)。
)=mol·L-1·s-1(写出计算式)。
-
(6) 实验2-2中,30s内未检测到(NH4)2S2O8与Na2S2O3反应,可能的原因是。(写出2条)。
 水解显碱性
水解显碱性 是两性氧化物
是两性氧化物
 是酸性氧化物
是酸性氧化物




