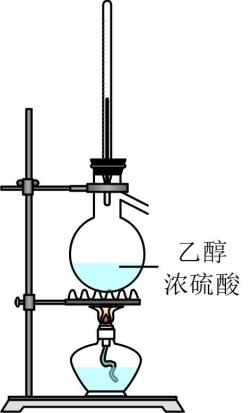
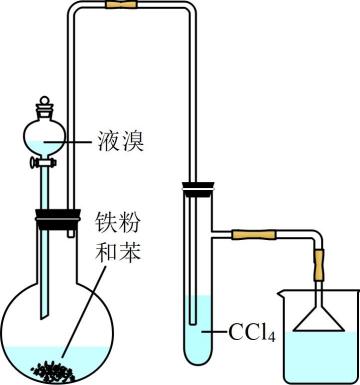
实验4-1 纯净物与混合物性质的比较 知识点题库
金属 | Na | Cu | Al | Fe |
熔点(℃) | 97.5 | 1083 | 660 | 1535 |
沸点/℃ | 883 | 2595 | 2200 | 3000 |
不能形成合金的两金属是( )
①合金至少含两种金属
②合金中元素以化合物形式存在
③合金的熔点比组成成分低
④合金一定是混合物
⑤铁锈是一种铁合金.
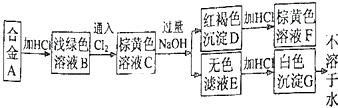
-
(1) 合金A由和组成;
-
(2) 写出下列变化的离子方程式:
C→E;
D→F.
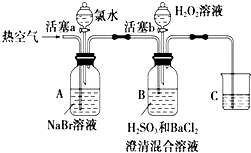
实验记录如下:
| 实验操作 | 现象及结论 |
Ⅰ | 打开活塞a,滴加氯水,关闭活塞 | A中溶液变为红棕色 |
Ⅱ | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化 |
Ⅲ | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
请回答下列问题:
-
(1) A中反应的离子方程式是.
-
(2) 实验操作Ⅱ吹入热空气的目的是.
-
(3) 装置C的作用是,C中盛放的药品是.
-
(4) 实验操作Ⅲ,混合液逐渐变成红棕色,其对应的离子方程式.
-
(5) 由上述实验得出的结论是.
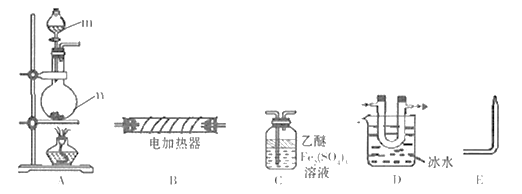
-
(1) 仪器m的名称为,装置C名称为。
-
(2) 实验室用白磷与NaOH浓溶液反应生成NaHPO2的同时制得PH3 , 反应的化学方程式为。
-
(3) 用装置A制取PH3 , 实验前,在仪器n中加入适量的乙醚和白磷并微热,然后才滴入浓NaOH溶液。实验前先微热的目的是。
-
(4) 将A、C、E依次相连,按照(3)中操作滴入浓NaOH溶液后,同时点燃E处导出的气体,若装置C中溶液黄色变浅,同时得到白色蜡状固体,说明PH3具有性,装置C中发生的化学反应方程式为,点燃E处气体的目的为。
-
(5) 将以上装置组合以证明PH3受热已分解,并验证PH3受热分解的气体产物,则仪器连接顺序为
A

 D
D 

 E( 在“
E( 在“  ”之间的空白处填写装置编号)。
”之间的空白处填写装置编号)。能证明PH3分解的气体产物的现象是。
回答下列问题:
-
(1) NaClO2所含的化学键类型有。
-
(2) 消毒剂投入水中,一段时间后与氨结合得到一种结合性氯胺(NH2Cl)。NH2Cl 在中性或酸性条件下也是一种强杀菌消毒剂,常用于城市自来水消毒。其理由是(用化学方程式表示)。
-
(3) “有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是每克含氯消毒剂的氧化能力相当于多少克Cl2 的氧化能力。上述四种含氯消毒剂中消毒能力最强的是。
-
(4) 自来水厂用ClO2 处理后的水中,要求ClO2 的浓度在0.1~0.8 mg·L-1之间。用碘量法检测ClO2 处理后的自来水中ClO2 浓度的实验步骤如下:
步骤Ⅰ.取一定体积的水样,加入足量碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。
步骤Ⅱ.用Na2S2O3 溶液滴定步骤Ⅰ中所得的溶液。
已知:a. 操作时,不同pH 环境中粒子种类如下表所示。
pH
2
7
粒子种类
Cl-
ClO2-
b. 2S2O32-+I2=S4O62-+2I-。
①步骤Ⅱ中反应结束时溶液呈(填“蓝色”或“无色”)
②若水样的体积为1.0L,在步骤Ⅱ中消耗10mL1.0×10-3mol·L-1Na2S2O3 溶液,则该水样中c(ClO2)=mg·L-1
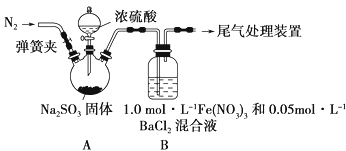
已知:1.0 mol·L-1的Fe(NO3)3溶液的pH=1,请回答下列问题:
-
(1) 装置A中反应的化学方程式是
-
(2) 为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是
-
(3) 装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
-
(4) 分析B中产生白色沉淀的原因:
猜想1:;
猜想2:SO2与Fe3+反应;
猜想3:在酸性条件下SO2与NO3-反应;
①按猜想2,装置B中反应的离子方程式是
②按猜想3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是 (填字母)。
a.0.1 mol·L-1硝酸钠溶液
b.1.5 mol·L-1Fe(NO3)2溶液
c.6.0 mol·L-1 NaNO3和0.2 mol·L-1盐酸等体积混合的溶液
ⅰ.称取 5 g 莫尔盐[(NH4)2 Fe(SO4)2·6H2O],用 15 mL 水和几滴 3 mol/L H2SO4 溶液 充分溶解,再加入 25 mL 饱和 H2C2O4 溶液,加热至沸,生成黄色沉淀
ⅱ.将沉淀洗涤至中性,加入 10 mL 饱和 K2C2O4 溶液,水浴加热至 40℃,边搅拌边 缓慢滴加 H2O2 溶液,沉淀逐渐变为红褐色;
ⅲ.将混合物煮沸 30 s,加入 8 mL 饱和 H2C2O4 溶液,红褐色沉淀溶解,趁热过滤, 滤液冷却后,析出翠绿色晶体,过滤、干燥。
Ⅱ.测定产品中铁的含量
ⅳ.称量 x g 制得的样品,加水溶解,并加入稀 H2SO4 酸化,再滴入 y mol/L KMnO4溶液使其恰好反应;
ⅴ.向ⅳ的溶液中加入过量 Zn 粉,反应完全后,弃去不溶物,向溶液中加入稀 H2SO4酸化,用 y mol/L KMnO4 溶液滴定至终点,消耗 KMnO4 溶液 z mL。
已知:H2C2O4 为二元弱酸,具有较强的还原性
-
(1) 莫尔盐[(NH4)2 Fe(SO4)2·6H2O]中铁元素的化合价是。
-
(2) 步骤ⅰ中黄色沉淀的化学式为 FeC2O4·2H2O,生成该沉淀的离子方程式是。
-
(3) 步骤ⅱ中除了生成红褐色沉淀,另一部分铁元素转化为[Fe(C2O4)3]3-。将下述反应的 离子方程式补充完整:
6 FeC2O4·2H2O ++= 4 [Fe(C2O4)3]3- + 2 Fe(OH)3↓ +H2O
-
(4) 步骤ⅱ中水浴加热的温度不宜过高,原因是。
-
(5) 步骤ⅳ在铁的含量测定中所起的作用是。
-
(6) 已知:ⅴ中 Zn 粉将铁元素全部还原为 Fe2+;反应中 MnO4-转化为 Mn2+。则该样品 中铁元素的质量分数是(用含 x、y、z 的代数式表示)
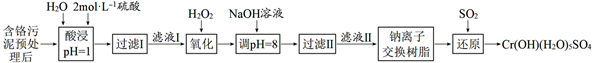
已知:①硫酸浸取液中的金属离子主要是Cr3+ , 其次是Fe3+、Al3+、Ca2+和Mg2+。
②Cr2O 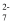 +H2O
+H2O  2CrO
2CrO 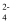 +2H+
+2H+
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9)溶解 |
-
(1) 实验室用18.4mol·L-1的浓硫酸配制480mL2mol·L-1的硫酸,配制时所用玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需。
-
(2) 加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O
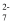 转化为(填微粒的化学式)。
转化为(填微粒的化学式)。
-
(3) 钠离子交换树脂的反应原理为Mn++nNaR=MRn+nNa+ , 则利用钠离子交换树脂可除去滤液II中的金属阳离子有。
-
(4) 写出上述流程中用SO2进行还原时发生反应的离子方程式:。
-
(5) 沉淀滴定法是测定粒子浓度的方法之一,为了测定某废水中SCN-的浓度,可用0.1000mol·L-1 AgNO3标准溶液滴定待测液,已知:
银盐性质
AgCl
AgI
AgCN
Ag2CrO4
AgSCN
颜色
白色
黄色
白色
砖红色
白色
Ksp
1.8×10-10
8.3×10-17
1.2×10-16
3.5×10-11
1.0×10-12
①滴定时可选为滴定指示剂的是(填编号),滴定终点的现象是。
A.NaCl B.K2CrO4 C.KI D.NaCN
②取某废水25.00mL,滴定终点时消耗AgNO3标准溶液10.00mL,则废水中SCN-的物质的量浓度为。
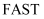 用到的碳化硅是一种新型陶瓷材料
用到的碳化硅是一种新型陶瓷材料
 B . 可用KSCN溶液鉴别
B . 可用KSCN溶液鉴别  溶液和
溶液和 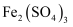 溶液
C . 合金的熔点一定比各成分金属的低
D . 稀土金属可以用于生产合金
溶液
C . 合金的熔点一定比各成分金属的低
D . 稀土金属可以用于生产合金
选项 | A | B | C | D |
目的 | 实验室制乙炔并检验乙炔 | 实验室制取少量的乙烯气体 | 证明酸性:碳酸>苯酚 | 实验室制备溴苯 |
实验方案 |
|
|
|
|