实验4-1 纯净物与混合物性质的比较 知识点题库

-
(1) 装置A的名称是
-
(2) 该实验装置检查气密性的方法是
-
(3) 如果将过二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后收集到的氯气少于0.06mol,其可能原因有
a.加热使浓盐酸放出大量HCl
b.盐酸变稀后不发生该反应
c.烧瓶中残留有氯气
d.装置B中液面高于A.
-
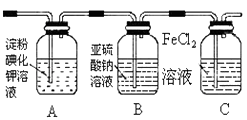
(1) 通入氯气后,A中的现象是.C装置中发生反应的离子方程式为:.
-
(2) 通入氯气一段时间后,洗气瓶B溶液中有一部分SO32﹣氧化成SO42﹣ . 设计试验方案,检验洗气瓶B溶液中Cl﹣和SO42﹣的存在.在答题卡上补充填写出实验步骤、预期现象和结论.
限选试剂及仪器:2mol/LHCl、2mol/LHNO3、1mol/LBaCl2溶液、1mol/LBa(NO3)2溶液、0.1mol/LAgNO3溶液、澄清石灰水、试管、胶头滴管.
实验步骤
预期现象和结论
步骤1:取适量洗气瓶B中溶液于试管A中,滴加.
若产生的白色沉淀,则洗气瓶B溶液中存在SO42﹣
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加.
产生白色沉淀.
步骤3:取步骤2后试管B中的上层清液于试管C中,滴加.
-
(3) 为准确测定通入氯气一段时间后剩余FeCl2的物质的量.实验如下:
①配制250mL 溶液:取洗气瓶C中全部溶液准确配制250mL溶液.
②滴定:准确量取25.00ml所配溶液于锥形瓶中,将0.1980mol/LKMnO4溶液装入,滴定至终点,记录数据.重复滴定2次.平均消耗KMnO4溶液V mL.(反应式:Fe2++MnO4﹣+H+﹣Fe3++Mn2++H2O,未配平)
③计算250mL溶液中FeCl2的物质的量= mol(只列出算式,不做运算).
ClO2的制备方法比较实用的有数十种,下列是几种常见的方法.
-
(1) 方法一:2NaClO3+4HCl(浓)=2NaCl+Cl2↑+2ClO2↑+2H2O
对于该反应,下列说法中正确的是 .
A . 该反应中Cl2是氧化产物 B . 该反应中NaCl、ClO2是还原产物 C . 在反应中HCl既作氧化剂又具有酸的作用 D . 1mol NaClO3参加反应时,有1mol电子发生转移 E . 1mol NaClO3参加反应,理论上能得到33.6L气体 -
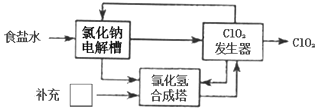
(2) 方法二:氯化钠电解法
该法工艺原理如图.其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2 . 指出工艺中方框中物质为(填化学式),理由为.
将NCl3与NaClO2(亚氯酸钠)按物质的量之比1:6混合,在碱性溶液中恰好反应生成ClO2 , 试写出该反应的离子方程式.
-
(3) 在用ClO2进行水处理时,除了杀菌消毒外,还能除去水中的Fe2+和Mn2+ . 试写出用ClO2氧化除去Mn2+生成MnO2的离子方程式(ClO2反应后的产物为ClO2﹣).


供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
-
(1) 小组同学设计甲、乙、丙三组实验,记录如下:
操作
现象
甲
向I的锥形瓶中加入,.向I的中加入30% H2O2溶液,连接I、Ⅲ,打开活塞
I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝
乙
向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯
Ⅲ中有气泡冒出,溶液不变蓝
丙
向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯
Ⅲ中有气泡冒出,溶液变蓝
-
(2) 丙实验中O2与KI溶液反应的离子方程式是。
-
(3) 对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是。为进一步探究该条件对反应速率的影响,可采取的实验措施是。
-
(4) 由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝。学生将I中产生的气体直接通入下列________溶液(填序号),证明了白雾中含有H2O2。A . 酸性 KMnO4 B . FeCl2 C . Na2S D . 品红
-
(5) 资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI +O2 +2H2O=2I2 + 4KOH。该小组同学取20 mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)造成的,请设计实验证明他们的猜想是否符合题意。
-
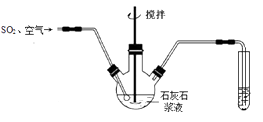
(1) 实验中为提高石灰石浆液脱硫效率采取的措施是,写出通入SO2和空气发生反应生成石膏(CaSO4·2H2O)的化学方程式。
-
(2) 将脱硫后的气体通入KMnO4溶液,可粗略判断烟气脱硫效率的方法是。
-
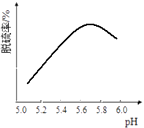
(3) 研究发现石灰石浆液的脱硫效率受pH和温度的影响。烟气流速一定时,脱硫效率与石灰石浆液pH的关系如图所示,在为5.7时脱硫效果最佳,石灰石浆液5.7<pH<6.0时,烟气脱硫效果降低的可能原因是,烟气通入石灰石浆液时的温度不宜过高,是因为。
-
(4) 石灰石烟气脱硫得到的物质中的主要成分是CaSO4和CaSO3 , 实验人员欲测定石灰石浆液脱硫后的物质中CaSO3的含量,以决定燃煤烟气脱硫时通入空气的量。请补充完整测定CaSO3含量的实验方案:取一定量石灰石烟气脱硫后的物质,。[浆液中CaSO3能充分与硫酸反应。实验中须使用的药品:75%的硫酸、标准浓度的(NH4)2Fe(SO4)2溶液,标准浓度的酸性KMnO4溶液]
①熔点低 ②硬度大 ③延展性好 ④导电性强 ⑤密度小 ⑥耐腐蚀
①合金的硬度一般比它的各成分金属的大
②一般地,合金的熔点比它的各成分金属的更低
③改变原料的配比、改变生成合金的条件,得到有不同性能的合金
④合金比纯金属的导电性更强
⑤合金比纯金属的应用范围更广泛
| | | | |
| A.向FeCl3溶液中滴入KSCN溶液,溶液颜色变红 | B.将混有少量氯化钾的硝酸钾饱和溶液在冰水中冷却,氯化钾晶体先析出 | C.向装有10mL溴水的分液漏斗中加入5mL正己烷,光照下振荡后静置,上、下层液体均接近无色 | D.将灼热的铜丝伸入盛有氯气的集气瓶中,铜丝剧烈燃烧,产生棕黄色的烟 |
|
选项 |
实验操作和现象 |
结论 |
|
A |
向Na2SiO3溶液中通入CO2 , 产生白色沉淀 |
碳的非金属性比硅的强 |
|
B |
向3mLKI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色 |
I-的还原性比Br-的强 |
|
C |
向溶液X中滴加KSCN溶液,无明显现象,再滴加新制氯水后溶液显红色 |
X中一定含Fe2+ |
|
D |
向溶液Y中滴加BaCl2溶液,出现白色沉淀,再加入足量稀盐酸,沉淀不溶解 |
Y中一定含 |
-
(1) 从氮元素的价态角度分析,NO有性。
-
(2) 以Cu和HNO3为原料制备NO,反应的化学方程式为。
-
(3) 设计实验探究NO的氧化性。
实验Ⅰ:用排水法收集一瓶NO,将其倒扣在盛有碱性Na2SO3溶液的水槽中,振荡,观察到集气瓶中液面上升。
资料:ⅰ.NO与碱性Na2SO3溶液会发生氧化还原反应,NO被还原为N2O
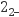 。
。ⅱ.Ag+与N2O
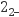 反应生成黄色沉淀。
反应生成黄色沉淀。①检验SO
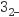 的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,(填操作和实验现象)。
的氧化产物。取少量实验Ⅰ反应后集气瓶中的溶液,(填操作和实验现象)。②某同学认为,需通过进一步实验验证NO的氧化性,补充以下实验:
实验Ⅱ:取饱和Na2SO4溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,无明显变化。
实验Ⅲ:取少量实验Ⅰ反应后集气瓶中的溶液,加入少量冰醋酸,再滴加5滴0.1mol/L的AgNO3溶液,(填实验现象)。
上述实验证明NO有氧化性。
实验Ⅱ的目的是。
③写出NO与碱性Na2SO3溶液反应的离子方程式。
④从电极反应角度分析NO与碱性Na2SO3溶液的反应。
还原反应:2NO+2e-=N2O
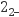
氧化反应:。
实验Ⅳ:用排水法收集两瓶NO,将其分别倒扣在饱和Na2SO3溶液和加有NaOH的饱和Na2SO3溶液中,后者集气瓶中液面上升更快。
根据上述实验所得结论:。
-
(4) 某同学结合所学知识设计处理工业废气中SO2和NO的实验方案,达到消除污染,保护环境的目的。
①先用饱和纯碱溶液吸收废气中的SO2 , 反应的化学方程式是。
②再向生成的溶液中加入一定量,以此溶液来吸收NO气体。
选项 | 实验操作和现象 | 实验结论 |
A | 向溶液X中先滴加稀盐酸酸化,再滴加Ba(NO3)2溶液,出现白色沉淀 | 溶液X中一定含有 |
B | 向淀粉溶液中加入稀硫酸,加热,冷却后加入新制氢氧化铜悬浊液,加热,未出现砖红色沉淀 | 淀粉未发生水解 |
C | 将SO2通入酸性高锰酸钾溶液,溶液褪色 | SO2有漂白性 |
D | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出沉淀所需时间缩短 | 其他条件不变,升高反应温度,化学反应速率加快 |









