实验4-1 纯净物与混合物性质的比较 知识点题库
在如图的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )
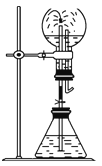

-
(1) 仪器C的名称是.安装F中导管时,应选用图2中的.
-
(2) 打开B的活塞,A中发生反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O.该反应中氧化剂与还原剂物质的量之比为,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜(填“快”或“慢”).
-
(3) 关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2 , 此时F中溶液的颜色不变,则装置C的作用是.
-
(4) 已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式为,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是
-
(5) 已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如题9图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是,原因是.

-
(1) 写出该实验中生成乙烯的化学方程式:
-
(2) 甲同学认为:考虑到该混合液体反应的复杂性,溴水褪色的现象不能证明反应中有乙烯生成且乙烯具有不饱和性,其理由正确的是 .A . 乙烯与溴水易发生取代反应 B . 使溴水褪色的物质,未必是加成反应 C . 使溴水褪色的物质,未必是乙烯
-
(3) 乙同学经过细致观察后认为:
试管中另一现象可证明反应中有乙烯生成,这个现象是.为验证这一反应是加成而不是取代,可用pH试纸来测试反应后溶液的酸性,理由是.
[提出问题]如何鉴别这两种无色溶液?
[实验方案]小琪等几位同学进行了如图所示的实验.

请你回答下列问题:
-
(1) C组实验中反应的化学方程式为;
-
(2) 其中不能达到实验目的是(填字母);
-
(3) D组实验中变浑浊的原溶液是.
[继续探究]实验结束后,小琪同学将A、B、C、D四组试管中的物质全部倒入同一个干净的烧杯中,充分反应后,得到无色澄清透明的溶液,对该溶液的成分又进行了探究.
[提出问题]该溶液中除水、酚酞外还含有哪些物质?
[查阅资料]氯化钙溶液呈中性.
[猜想与假设]Ⅰ.
Ⅱ.NaCl、CaCl2、HCl
Ⅲ.NaCl、CaCl2、NaOH
[反思与拓展]①上述猜想与假设中只有一个不成立,它是(填序号),理由是.
②根据所学化学知识,验证烧杯内溶液中可能有的物质是否存在,下列哪些物质单独使用不能完成该实验(填字母)
a.pH试纸 b.硝酸银溶液 c.紫色石蕊试液 d.铜 e.足量氢氧化钠溶液.
-
(1) 【实验I】SO2与漂粉精反应.
操作
现象
取4g 漂粉精固体,加入100mL 水
部分固体溶解,溶液略有颜色
过滤,测漂粉精溶液的pH
pH 试纸先变蓝(约为12),后褪色

1.液面上方出现白雾;
2.稍后,出现浑浊,溶液变为黄绿色;
3.稍后,产生大量白色沉淀,黄绿色褪去
Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为.
-
(2) pH试纸颜色的变化说明漂粉精溶液具有的性质是.
-
(3) 兴趣小组将A中产生的白雾引出导入硝酸酸化的AgNO3溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?请说明理由.
-
(4) 现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl﹣发生反应.该反应的离子方程式为.
-
(5) ①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是(填化学式);
②用离子方程式解释现象3中黄绿色褪去的原因.
-
(6) 【实验II】SO2与过氧化钠反应.将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好.在室温下按图示装置进行实验,请填写空白.
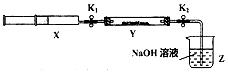
操作步骤
实验现象
解释原因
打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应)
(1)
(2)反应的化学方程式:
将注射器活塞退回原处并固定,待装置恢复到室温,打开K2
(3)
(4)不用解释
| A.青铜雁鱼灯 | B.光导纤维 | C.航母甲板(钢) | D.潜水器外壳(钛、铝等) |
| | | | |
| 选项 | A | B | C | D |
| 实验装置 | | | | |
| 实验目的 | 完成“喷泉”实验 | 测定中和热 | 制取并收集干燥纯净的NH3 | 制取NO |
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将氯乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验水解产物中的氯离子 |
| B | 向丙醛溶液中加入新制的银氨溶液,用酒精灯直接加热 | 确定丙醛中是否含有醛基 |
| C | 向工业酒精中加入无水硫酸铜 | 确定工业酒精中是否含有水 |
| D | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | 检验制得的气体是否为乙烯 |
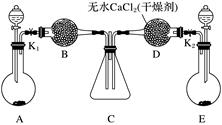
-
(1) A和E中制取NH3的装置为,所用试剂为,装置中制取NO2的化学方程式是。
-
(2) 若NO2能够被NH3还原,预期观察到C装置中的现象是。
-
(3) 实验过程中,一段时间内未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NH3还原性较弱,不能将NO2还原;②在此条件下,NO2的转化率极低;③。
-
(4) 此实验装置存在一个明显的缺陷是。
-
(1) 方案1:通过置换反应比较:向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是,说明氧化性Ag+>Cu2+。
-
(2) 方案2:通过Cu2+、Ag+分别与同一物质反应进行比较
实验
试剂
编号及现象
试管
滴管

1.0mol·L-1 KI溶液
1.0mol·L-1AgNO3溶液
Ⅰ.产生黄色沉淀,溶液无色
1.0mol·L-1 CuSO4溶液
Ⅱ.产生白色沉淀A,溶液变黄
①经检验, Ⅰ中溶液不含I2 , 黄色沉淀是。
②经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是Cul,确认A的实验如下:

a.检验滤液无I2。溶液呈蓝色说明溶液含有 (填离子符号)。
b.白色沉淀B是 。
c.白色沉淀A与AgNO3溶液反应的离子方程式是。说明氧化性Ag+>Cu2+。
-
(3) 分析方案2中Ag+未能氧化I- , 但Cu2+氧化了的原因,设计实验如下:
编号
实验1
实验2
实验3
实验



现象
无明显变化
a中溶液较快变棕黄色,b中电上折出银;电流计指针偏转
C中溶液较慢变浅黄色;电流计指针偏转
(电极均为石墨,溶液浓度均为1mol/L,b、d中溶液pH≈4)
①a中溶液呈棕黄色的原因是 (用电极反应式表示)。
②“实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是 。
③方案2中,Cu2+能氧化I- , 而Ag+未能氧化I-的原因。
(资料:Ag++I-=AgI↓ K1=1.2×1016;2Ag++2I-=2Ag↓+I2 K2=8.7×108)
2Na2CO4 + 4HCl = 4NaCl + 2CO2↑ + O2↑ + 2H2O市售过碳酸钠中一般都含有碳酸钠,为测定某过碳酸钠样品(只含Na2CO4和Na2CO3)的纯度,某化学兴趣小组采用以下方案实施:按如图组装好实验装置,Q为一可鼓胀收缩的塑料气袋(该气袋耐酸碱腐蚀),取适量样品于其中,打开分液漏斗活塞,将足量稀盐酸滴入气袋中至充分反应。
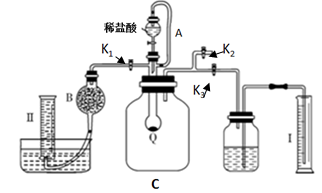
-
(1) 过碳酸钠的化学式也可表示为 aNa2O2· bNa2CO3 , 请写出Na2O2的电子式:
-
(2) 仪器B的名称为,导管A的作用是
-
(3) 该实验共需测定两个数据,首先需测定反应所生成的气体的总体积,故滴加稀盐酸前必须关闭和并打开(均填“K1”、“K2”或“K3”)
-
(4) 其次用量筒Ⅱ测定混合气体中某种成分的体积,则 B中装的固体试剂名称为,具体测定过程如下:当Q中反应停止后,使 K1 和 K3 处于关闭状态, K2处于打开状态,再缓缓打开K1即可。
-
(5) 实验结束时,装置内的气体同温同压,测得量筒I中有x mL水,量筒Ⅱ中收集到了y mL气体,则样品中过碳酸钠的质量分数是(用含有x、y的代数式表示)。
 的新型合金材料
C . 中国天眼
的新型合金材料
C . 中国天眼  用到的碳化硅是一种新型陶瓷材料
D . 石墨烯是一种具有优异性能的新型材料
用到的碳化硅是一种新型陶瓷材料
D . 石墨烯是一种具有优异性能的新型材料
已知:①K2FeO4为紫色固体,微溶于KOH溶液;
②  具有强氧化性,在酸性或中性溶液中能快速产生O2 , 在碱性溶液中较稳定。
具有强氧化性,在酸性或中性溶液中能快速产生O2 , 在碱性溶液中较稳定。

-
(1) 制备K2FeO4(夹持装置略)
①如图所示,A为氯气发生装置,装置A中盛放KMnO4的仪器名称是。
②装置B的作用是。
③装置C中的KOH溶液需过量,目的是。
④C中得到紫色固体和溶液。则C中Cl2与Fe(OH)3发生反应生成K2FeO4的离子方程式为
-
(2) 探究K2FeO4的性质甲同学取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。该现象(填“能”或“不能”)证明“酸性条件下
 氧化性强于Cl2”,并说明理由:。
氧化性强于Cl2”,并说明理由:。
-
(3) 测定K2FeO4的产率若在制备装置C中加入Fe(OH)3的质量为10.7g,充分反应后经过滤、洗涤、干燥得K2FeO4固体9.9g,则K2FeO4的产率为。
 )水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
)水溶液除去H2S,并使用2 mol·L-1 CuSO4溶液检验H2S是否除尽。
回答下列问题:
-
(1) 仪器1的名称是。装置甲制取CO2 , 实验室制取CO2的离子方程式为。
-
(2) 仪器2盛装0.001 mol·L-1H2S水溶液,三颈烧瓶丙中盛装溶液是。
-
(3) 操作步骤:
①打开开关A、C,放入酸溶液产生CO2 , 目的是;
②一段时间后,关小开关C的出气量,打开压缩机开关,同时打开活塞放入H2S水溶液;逐渐减缓仪器1中酸溶液滴入速率并控制气压。使用CO2压缩机的作用是。
-
(4) 通入二氧化碳所形成的混合气体中,经测量含H2S的量为1000 ×10-6mg·m-3 , 则该混合气体中c(H2S)计算式为mol·L-1。
-
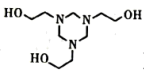
(5) 三嗪(
 )水溶液吸收H2S,生成
)水溶液吸收H2S,生成 和
和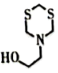 化学方程式为。CuSO4溶液没有出现 (填现象), 证明三嗪吸收H2S的化学反应具有、等特征,20%三嗪水溶液是很好的脱硫剂。
化学方程式为。CuSO4溶液没有出现 (填现象), 证明三嗪吸收H2S的化学反应具有、等特征,20%三嗪水溶液是很好的脱硫剂。











