实验4-1 纯净物与混合物性质的比较 知识点题库
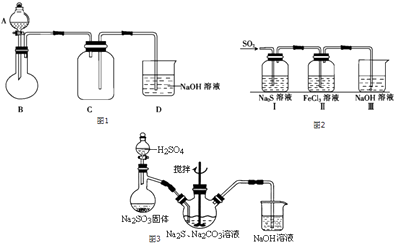
【SO2的制备】用亚硫酸钠与较浓的硫酸反应制备SO2的装置图如图1(夹持仪器省略):
-
(1) 图中的装置错误的是;B中发生反应的化学方程式为;D的作用是.
-
(2) 【SO2的性质】探究SO2气体性质的装置如图2所示:
装置Ⅰ中的现象是,写出装置Ⅰ中通入足量SO2的离子方程式.
-
(3) 在上述装置中通入过量的SO2 , 为了验证Ⅱ中发生了氧化还原反应,取Ⅱ中溶液分成两份,
并设计了如下实验:
方案一:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去;
方案二:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
上述方案不合理的方案是,原因是,写出解释该原因的离子方程式.
-
(4) SO2可以用来制备硫代硫酸钠,硫代硫酸钠可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过Na2S、Na2CO3和SO2共同反应来制取Na2S2O3 . 写出如图3所示装置中三颈瓶中由反应制取Na2S2O3的化学方程式.

-
(1) 如图1是中学化学中常用于混合物分离和提纯的装置,请回答问题:
①用CCl4可以从碘水中提取碘,该分离方法的名称为,应选择下图中装置.
②从氯化钠溶液中得到氯化钠固体,应选择下图中的装置.
③装置丁中仪器B的名称是,冷水进水方向:从(填“e”或“f”)口进水.
④乙、丙中玻璃棒的作用分别是.
-
(2) 已知:加热条件下,氨和氧化铜可以发生反应:2NH3+3CuO
 3Cu+N2+3H2O反应可以在如图2装置中进行.请回答下列问题:
3Cu+N2+3H2O反应可以在如图2装置中进行.请回答下列问题: ①A中可采用实验室制法来制取氨,化学方程式为.
②B中加入的干燥剂可选用(填代号).a 碱石灰 b无水氯化钙 c 浓硫酸
③能证明氨与氧化铜反应的现象是:C中;D中.
Ⅰ.某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图1所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.
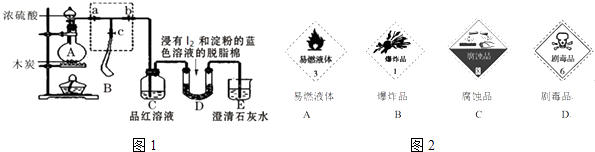
请回答下列问题
-
(1) 对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签如图2.浓硫酸的危险警告标签是.
-
(2) 装置A中发生反应的化学方程式为.
-
(3) 此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
-
(4) 实验时,装置C中的现象为;
-
(5) 当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2 , 而不是SO2;写出D中发生反应的化学方程式,并标出电子转移方向和数目.
-
(6) Ⅱ. Cu与浓硫酸反应可得硫酸铜溶液.某学习小组将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气也可得硫酸铜溶液,其反应原理为2Cu+O2+2H2SO4═2CuSO4+2H2O.现欲将12.8g铜完全溶解,加蒸馏水后得200mL溶液.计算:
参加反应的氧气在标准状况下的体积是L.(不必写计算过程)
-
(7) 所得硫酸铜溶液的物质的量浓度是mol/L(不必写计算过程)
-
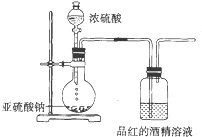
(1) 制备SO2气体的反应方程式为:.发生装置的玻璃仪器名称为、.
-
(2) 为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置设计中的不合理之处.
①;②
-
(3) 按照修改后的装置,实验中控制SO2以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色,这说明品红褪色不是SO2直接导致的.据此,SO2能使品红的水溶液褪色的可能微粒有(不考虑水及水电离出来的粒子).
-
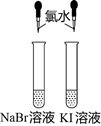
(1) 提出问题:Fe3+、Br2哪个氧化性更强?
猜想:①甲同学认为氧化性:Fe3+>Br2 , 故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+ , 故上述现象是发生氧化还原反应所致,则溶液呈黄色是含所致.
-
(2) 设计实验并验证丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的.
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在表中写出丙同学选用的试剂及实验中观察到得现象.
选用试剂(填序号)
实验现象
方案1
方案2
-
(3) 结论
氧化性:Br2>Fe3+ . 故在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为.
-
(4) 实验后的思考
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先被氧化的离子是.
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有
 的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为.
的Br﹣被氧化成单质Br2 , 则原FeBr2溶液的物质的量浓度为.
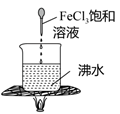
查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O发生反应:
2Na2O2+2CO2═2Na2CO3+O2
2Na2O2+2H2O═4NaOH+O2↑
请回答下列问题:

-
(1) 装置A的作用是.
-
(2) 为确定反应后装置B硬质玻璃管中固体的成分,小组同学取适量固体于试管中,加入足量的蒸馏水溶解形成溶液M,无气泡产生,则该固体中不含,该小组同学继续进行探究.
-
(3) 【提出问题】反应后硬质玻璃管中固体的成分是什么?
【做出猜想】猜想一:Na2CO3猜想二:NaOH 猜想三:Na2CO3和NaOH
经过讨论,大家一致认为猜想不合理,理由是.
-
(4) 【实验验证】小组同学取上述形成的溶液M于试管中,向其中加入过量的溶液,若产生白色沉淀,过滤,向滤液中滴加几滴酚酞试液,溶液变红,则证明猜想三成立.
-
(5) 【交流反思】小组中有同学认为,将上述滤液中滴加的酚酞试液换成硝酸铜溶液,也能得出同样的结论,
你认为该同学的观点(填“正确”或“错误”),理由是.
-
(6) 【拓展延伸】在盛有氯化铵(NH4Cl)浓溶液的试管中,加入足量的过氧化钠(Na2O2)固体,有气泡产生,产生的气体是.
实验 | 试剂 | 现象 | |
滴管 | 试管 |
| |
| 0.2mol/L Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ产生白色沉淀 |
0.2mol/LCuSO4溶液 | Ⅱ溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1mol/LAl2(SO4)3溶液 | Ⅲ开始无明显变化,继续滴加产生白色沉淀 | ||
-
(1) 经检验,现象Ⅰ中的白色沉淀是Ag2SO3 . 用离子方程式解释现象Ⅰ:.
-
(2) 经检验,现象Ⅱ的棕黄色沉淀中不含SO42﹣ , 含有Cu+、Cu2+和SO32﹣ .
已知:Cu+
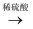 Cu+Cu2+ , Cu2+
Cu+Cu2+ , Cu2+  CuI↓(白色)+I2 .
CuI↓(白色)+I2 . ①用稀硫酸证实沉淀中含有Cu+的实验现象是.
②通过下列实验证实,沉淀中含有Cu2+和SO32﹣ .
a.白色沉淀A是BaSO4 , 试剂1是.
b.证实沉淀中含有Cu+和SO32﹣的理由是.



选项 | 实验仪器 | 实验目的 |
A | 酸碱通用滴定管、锥形瓶 | 用标准NaOH溶液测定待测盐酸的浓度 |
B | 分液漏斗、烧杯 | 提取溴的CCl4溶液中的溴单质 |
C | 酒精灯、玻璃棒 | 利用焰色反应检验溶液中含有K+ |
D | 250mL容量瓶、玻璃棒 | 配制250mL0.1mol·L-1碳酸钠溶液 |
| A | B | C | D | |
| 实验方案 | | | | |
| 实验目的 | 验证FeCl3对H2O2分解反应有催化作用 | 验证单质氧化性: Cl2>Br2>I2 | 加热至混合液呈红褐色,停止加热,制备Fe(OH)3胶体 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
|
|
|
|
A.返回舱与推进舱分离时使用的推进剂——液氧和液氢 | B.航天员返回途中穿着的航天服——合成纤维及尼龙膜 | C.返回舱减速伞材料——高强度锦纶纤维 | D.返回舱侧壁壳体——高强度铝合金 |
 易溶于水、乙醇和乙醚,常用作漂白剂和还原剂,
易溶于水、乙醇和乙醚,常用作漂白剂和还原剂, 在酸性条件下还原性较差,碱性条件下较强。某实验小组用如下装置制备
在酸性条件下还原性较差,碱性条件下较强。某实验小组用如下装置制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
-
(1) 装置B中浓硫酸的作用是;实验中观察到:装置C中溶液红色没有褪去,装置D中溶液红色褪去。由此可得出的结论是。
-
(2) 为了进一步探究使品红褪色的主要微粒,进行如下系列实验:
实验
试管中的溶液
滴入溶液
实验现象
a
 溶液(
溶液(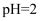 )
)各滴入1滴0.1%品红溶液
溶液变红逐渐变浅,约90s后完全褪色
b
 溶液(
溶液(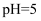 )
)溶液变红后立即变浅,约15s后完全褪色
c
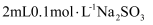 溶液(
溶液(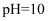 )
)溶液变红后立即褪色
综合上述实验推知,
 水溶液使品红褪色时起主要作用的微粒是(填微粒符号)。
水溶液使品红褪色时起主要作用的微粒是(填微粒符号)。 -
(3) 用
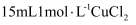 溶液和
溶液和 溶液制备
溶液制备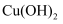 悬浊液,实验中观察到:装置E中生成大量白色沉淀,溶液呈绿色,与
悬浊液,实验中观察到:装置E中生成大量白色沉淀,溶液呈绿色,与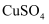 溶液、
溶液、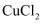 溶液的颜色明显不同。
溶液的颜色明显不同。①为探究白色沉淀的成分,查阅资料如下:CuCl为白色固体,难溶于水,能溶于浓盐酸,与氨水反应生成
 , 在空气中立即被氧化成含有蓝色
, 在空气中立即被氧化成含有蓝色 的溶液。
的溶液。甲同学向洗涤后的白色沉淀中加入氨水,得到蓝色溶液,此过程中反应的离子方程式为
 、。
、。乙同学设计一个简单实验方案证明白色沉淀为CuCl:;装置E中生成白色沉淀的离子方程式为。
②为探究E中溶液呈绿色而不是蓝色的原因,向
 溶液中通入过量
溶液中通入过量 , 未见溶液颜色发生变化,目的是;取少量E中滤液,加入少量稀盐酸,产生无色刺激性气味气体,得到澄清蓝色溶液,故推断溶液显绿色的原因可能是溶液中含有较多
, 未见溶液颜色发生变化,目的是;取少量E中滤液,加入少量稀盐酸,产生无色刺激性气味气体,得到澄清蓝色溶液,故推断溶液显绿色的原因可能是溶液中含有较多 。为进一步实验确认这种可能性,向少量
。为进一步实验确认这种可能性,向少量 溶液中加入(填化学式),得到绿色溶液。
溶液中加入(填化学式),得到绿色溶液。