实验4-1 纯净物与混合物性质的比较 知识点题库
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )

I.课本介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2mL乙醇的试管里,反复操作几次.注意闻生成物的气味,并观察铜丝表面的变化.
-
(1) 小赵同学用化学方法替代“闻生成物的气味”来说明生成物的出现,该化学方法中所另加的试剂及出现的主要现象是(用所学的知识回答)
-
(2) 小赵同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入足量的乙醛溶液,可以看到溴水褪色.该同学为解释上述现象,提出三种猜想:
①溴与乙醛发生取代反应;
②;
③由于醛基具有还原性,溴将乙醛氧化为乙酸.
为探究哪种猜想正确,小李同学提出了如下两种实验方案:
方案一:用pH试纸检测溴水褪色后溶液的酸碱性;
方案二:测定反应前溴水中Br2的物质的量和反应后溶液中Br﹣的物质的量.
-
(3) 方案一是否可行(填“是”或“否”),理由是.
-
(4) 小李同学认为:假设测得反应前溴水中Br2的物质的量为amol,若测得反应后n(Br﹣)=mol,则说明溴与乙醛发生取代反应.
-
(5) 小吴同学设计如下实验方案:
①按物质的量之比为1:5配制KBrO3﹣KBr溶液,加合适的适量的酸,完全反应并稀至1L,生成0.5molBr2 .
②取上述溶液10mL加入足量乙醛溶液,使之褪色,然后将所得溶液稀释为100mL,准确量取其中10mL.
③加入过量的AgNO3溶液,过滤、洗涤、干燥后称量得到淡黄色固体0.188g.
试通过计算判断:溴与乙醛发生反应的化学方程式为
Ⅱ.小刘同学在查阅资料时得知,乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸.依据此原理设计实验并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体).已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全.有关物质的沸点见表:
物质
乙醛
乙酸
甘油
乙二醇
水
沸点
20.8℃
117.9℃
290℃
197.2℃
100℃
请回答下列问题:
-
(6) 试管A内在60℃~80℃时发生的主要反应的化学方程式为(注明反应条件).
-
(7) 如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在;目的是;当试管A内的主要反应完成后温度计水银球的位置应在,目的是.
-
(8) 烧杯B内盛装的液体可以是(写出一种即可,在题给物质中找).

-
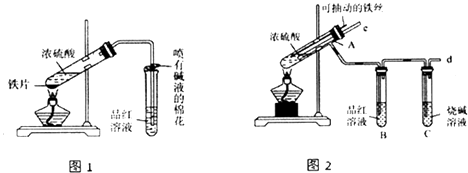
(1) 比较两实验装置,图2装置的优点是:
①能更好地吸收有毒气体SO2 , 防止其污染环境;②.
-
(2) 导气管e有两个主要作用:一是在反应过程中,因导管插入液面下,可起到“液封”作用阻值SO2 气体逸出而防止污染环境;二是.
-
(3) 能说明有SO2气体产生的实验现象是.
-
(4) 反应一段时间后,用滴管吸取A试管中的溶液滴入适量水中为试样,试样中所含金属离子的成分有 以下三种可能:
I:只含有Fe3+;Ⅱ:只含有Fe2+;Ⅲ:既有Fe3+又有Fe2+ .
为验证Ⅱ、Ⅲ的可能性,选用如下试剂,填写下列空格:
A.稀HCl溶液 B.稀硫酸 C.KSCN溶液 D.KMnO4溶液
E.NaOH溶液 F.淀粉KI溶液 G.H2O2溶液
验证Ⅱ:取试样,先滴加少量的(填试剂序号,下同),振荡,再滴加少量的,根据溶液颜色的变化可确定假设Ⅱ是否正确.
验证Ⅲ:步骤1.取试样,滴加少量的(填试剂序号,溶液的颜色变色,则试样中含有Fe3+ , 发生反应的离子方程式为;
步骤2.再取适量的试样,滴加少量的(填试剂序号),溶液颜色的变化为,则试样中含有Fe2+ .
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”.
请完成该实验中的问题.
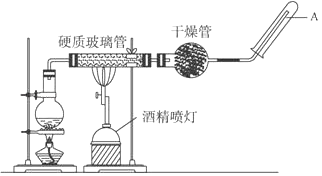
-
(1) 写出该反应中还原产物是.
-
(2) 圆底烧瓶中盛装的水,该装置受热后的主要作用是;
-
(3) 烧瓶底部放置了几片碎瓷片,碎瓷片的作用是.
-
(4) 干燥管中盛装的物质是碱石灰作用是.
-
(5) 如果要在A处玻璃管处点燃该气体,则必须对该气体进行.

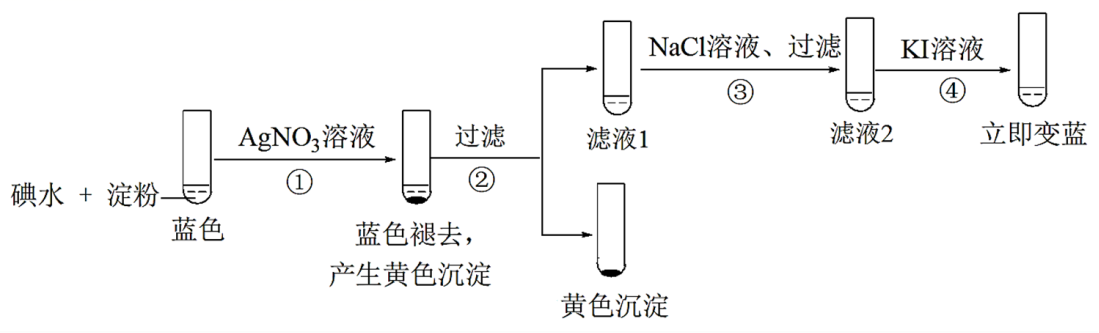
进行探究,并对所得气体产物和固体产物进行验证(查阅资料得知:三草酸合铁酸钾热分解的气体产物中含有 CO和 CO2)。利用下图装置进行实验(夹持仪器已略去)。
 回答下列问题:
回答下列问题:
-
(1) 按气流方向各装置依次连接的合理顺序为; (填接口代号,装置可重复使用)
-
(2) 反应开始前依次进行如下操作:组装仪器、、加药品、通氮气一段时间后点燃酒精灯。反应结束后的操作包括:①停止通氮气②熄灭酒精灯③冷却至室温。正确的顺序为;
-
(3) 通入氮气的目的是。
-
(4) 实验中观察到第一个澄清石灰水变浑浊,则说明气体产物中有(写化
学式)。能证明分解产物中有 CO气体生成的实验现象是。
样品完全分解后,装置 B中的残留物含有 FeO和 Fe2O3
-
(5) 测定三草酸合铁酸钾中铁的含量。
①将装置B中完全分解后的残留物置于锥形瓶中,溶解后加稀 H2SO4 酸化,xmol• L-1
kMNO4溶液滴定至终点。滴定终点的现象是。该过程发生反应的离子方程式为。
②向上述溶液中加入过量 KI—淀粉溶液,充分反应后,用y mol• L-1Na2S2O3 标准溶液滴定至终点,消耗 Na2S2O3溶液V mL(已知I2+2S2O32- =2I-+S4O62- )。该晶体中铁的质量分数的表达式为 。
| 选项 | 实验操作及实验现象 | 实验结论 |
| A | 向蔗糖溶液中滴加几滴稀H2SO4 , 水浴加热几分钟后,再加入银氨溶液继续水浴加热,未在试管内壁上形成银镜 | 蔗糖未发生水解反应 |
| B | 将油脂、乙醇和氢氧化钠溶液混合加热几分钟,用胶头滴管取少量混合物滴入蒸馏水中,液体表层无剩余油滴 | 油脂已完全水解 |
| C | 将乙醇和浓H2SO4的混合物迅速升温至170℃,并将产生的气体通入到酸性KMnO4溶液中,酸性KMnO4溶液紫色变浅 | 反应生成了乙烯 |
| D | 向蛋白质溶液中加入浓HNO3 , 析出白色固体 | 蛋白质发生了颜色反应 |
| 实验 | 实验操作和现象 |
| 1 | 测得0.1mol·L−1Na2C2O4溶液的pH≈8.4 |
| 2 | 向0.2mol·L−1Na2C2O4溶液中加入等体积0.2mol·L−1盐酸,测得混合后溶液的pH≈5.5 |
| 3 | 向0.1mol·L−1Na2C2O4溶液中滴加几滴酸性KMnO4溶液,振荡,溶液仍为无色 |
| 4 | 向0.1mol·L−1Na2C2O4溶液中加入等体积0.1mol·L−1CaCl2溶液,产生白色沉淀 |
下列有关说法错误的是( )
 )
B . 实验2得到的溶液中有c(H2C2O4)>c(Cl-)>c(C2O
)
B . 实验2得到的溶液中有c(H2C2O4)>c(Cl-)>c(C2O  )
C . 实验3中MnO
)
C . 实验3中MnO  被还原成Mn2+ , 则反应的离子方程式为2MnO
被还原成Mn2+ , 则反应的离子方程式为2MnO  +5C2O
+5C2O  +16H+=2Mn2++10CO2↑+8H2O
D . 依据实验4可推测Ksp(CaC2O4)<2.5×10−3
+16H+=2Mn2++10CO2↑+8H2O
D . 依据实验4可推测Ksp(CaC2O4)<2.5×10−3

-
(1) 他们制备Cl2依据的原理是:MnO2+ 4HCl(浓)
 MnCl2+ 2H2O + Cl2↑,应选用上图A、E装置中的(填序号)制Cl2 , 反应中浓盐酸所表现出的性质是、。
MnCl2+ 2H2O + Cl2↑,应选用上图A、E装置中的(填序号)制Cl2 , 反应中浓盐酸所表现出的性质是、。
-
(2) 反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是。
-
(3) NaOH溶液分别与两种气体反应的离子方程式是、。
-
(4) 该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色。查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是。
下列分析不正确的是( )
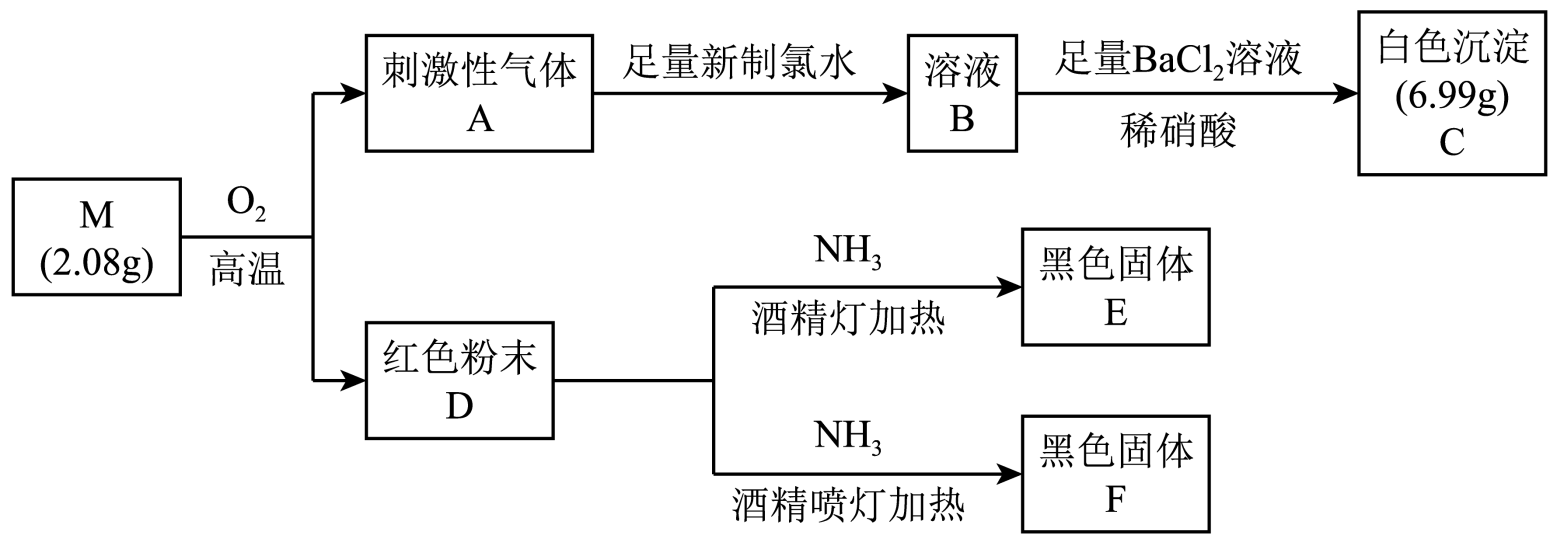
回答下列问题:
-
(1) D是(填化学式)。
-
(2) 根据上述信息推知,M是(填化学式)。
-
(3) 将A通入新制氯水中发生主要反应的离子方程式为。
-
(4) 为了探究温度对D和氨气反应的产物的影响,设计如下实验:
步骤
操作
E(甲组)
F(乙组)
I
取少量产物,加入稀盐酸
溶解、无气泡
溶解,有气泡
II
取步骤I中溶液,滴加KSCN溶液
溶液变红
无明显变化
III
向步骤II溶液中滴加双氧水
红色变深
溶液变红
①根据上述现象,得出实验结论:E为X3O4(X表示形成化合物M的一种元素),F为(填化学式)。
②乙组实验中,步骤III中溶液由无色变红的原因是(用离子方程式表示)。
③通过交流、讨论,有人认为E中除X3O4外还可能含单质X,判断的理由是。
 的性质进行下列实验,其中能达到实验目的的是( )
的性质进行下列实验,其中能达到实验目的的是( )
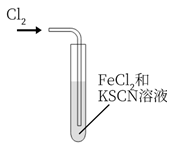 探究
探究 的氧化性
B .
的氧化性
B . 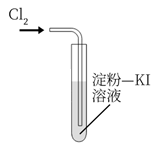 探究
探究 的漂白性
C .
的漂白性
C .  模拟工业制漂白粉
D .
模拟工业制漂白粉
D . 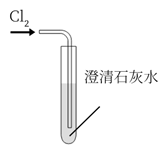
 尾气处理
尾气处理
实验操作 | 实验现象 | 实验结论 | |
A | 将水滴入盛有 | 观察到有气泡产生,木条复燃 |
|
B | 在100mL小烧杯中加入 | 液体呈红褐色 | 实验制得了 |
C | 将铂丝放在酒精灯外焰上灼烧,至与原来的火焰颜色相同。用铂丝蘸取某无色溶液,在外焰上灼烧 | 火焰呈黄色 | 溶液中含 |
D | 向盛有 | 有红色固体析出 |
|
 固体的试管中,立即把带火星的木条放在试管口
固体的试管中,立即把带火星的木条放在试管口
 稀溶液,加热至沸腾,向其中慢慢滴入5~6滴氯化铁饱和溶液,继续煮沸片刻,停止加热
稀溶液,加热至沸腾,向其中慢慢滴入5~6滴氯化铁饱和溶液,继续煮沸片刻,停止加热 胶体
胶体 元素,不含K元素
元素,不含K元素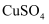 溶液的试管中加入铁粉
溶液的试管中加入铁粉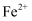 的氧化性强于
的氧化性强于 的氧化性
的氧化性


