实验4-1 纯净物与混合物性质的比较 知识点题库

(1)外观暗灰色,表皮光滑.
(2)在酒精灯上灼烧,火焰绿色;合金片熔化,但不滴落.
(3)取刮去表皮的金属,放入足量稀硫酸中,收集到标准状况下氢气9.96 L.
(4)另取刮去表皮的金属,放入足量氢氧化钠溶液中,也收集到标准状况下氢气9.96 L.
试据此判断,合金中含有的成分是( )

-
(1) 甲同学在a、b、c、d四只烧杯里分别加入50mL冷水,再分别滴加几滴酚酞溶液,依次加入大小相近的钠(Na)、镁(Mg)、铝(Al)、钾(K)金属块,观察现象.
①甲同学设计实验的目的是验证:同一主族,从上到下元素的元素金属性逐渐增强;同一周期,从左到右,元素金属性;
②反应最剧烈的烧杯里金属是(填字母)
A、钠 B、镁 C、铝 D、钾;
③写出a烧杯里发生反应的离子方程式.
④实验中发现b、c两只烧杯中几乎没有什么现象,要想达到实验的目的,请你帮助选择下列合适的方法.
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液
-
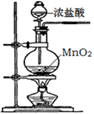
(2) 乙同学设计实验验证:非金属元素的非金属性越强,其最高价含氧酸的酸性就越强.他设计了如图装置以验证碳、氮、硅元素的非金属性强弱.乙同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,其浓溶液在常温下可与铜反应;B是块状固体;烧杯中盛放C的水溶液,打开分液漏斗的活塞后,C中可观察到白色胶状沉淀生成.
①写出所选用物质的化学式:A、; C、.
②写出烧瓶中发生反应的化学方程式:.
③碳、氮、硅三种元素的非金属性由强到弱顺序为.

C2H5OH+HBr→C2H5Br+H2O
主要实验步骤如下:①连接好装置,检查装置的气密性;②向烧瓶中加入一定量的苯和液溴.向锥形瓶中加入乙醇和浓H2SO4的混合液至稍高于进气导管口处;③将A装置中的纯铁丝小心向下插入混合液中;④点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10min.
请填写下列空白:
-
(1) 写出制取溴苯的化学方程式:.
-
(2) 步骤③中观察到的现象是:.
-
(3) C装置中U形管内部用蒸馏水封住管底的作用是:.
-
(4) 反应完毕后,U形管内的现象是:.分离溴乙烷时所用的最主要仪器的名称是(只填一种).
-
(5) 实验结束,从烧瓶的混合物中分离出粗制黄色的溴苯,产生黄色的原因是其中含有(填化学式).欲得到无色的溴苯的方法是(填试剂和操作名称).

-
(1) 仪器A的名称,其作用是.
-
(2) 用仪器B滴加液体并不需要打开玻璃塞c,原因是.
-
(3) 实验记录如下(请补全空白):
步骤
实验操作
实验现象
实验结论
Ⅰ
打开活塞a,逐滴加入H2SO3溶液至过量
Ⅱ
向步骤Ⅰ所得溶液中逐滴加入H2O2溶液
刚开始溶液颜色无明显变化,继续滴加,溶液变为橙黄色
-
(4) 步骤Ⅱ中,开始时颜色无明显变化的原因是(写出一条),
步骤Ⅰ中反应的离子方程式,
步骤Ⅱ中主要反应的离子方程式.
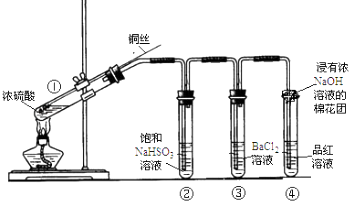
-
(1) ①中反应的化学方程式是,其中铜发生了(填“氧化”或“还原”)反应,判断依据为.
-
(2) ②中饱和NaHSO3溶液的作用是除去①中挥发出的硫酸.加热一段时间后,③中溶液依然澄清,④中溶液褪色.想要立即终止铜与硫酸的反应,最恰当的方法是.
a.上移铜丝,使其脱离硫酸
b.撤去酒精灯
c.拔去橡胶塞倒出硫酸
-
(3) 反应停止后,待装置冷却,把③取下后将其中溶液分成两份做如下实验:
加入试剂
现象
反应的离子方程式
第一份
加入NaOH溶液
有白色沉淀生成
第二份
加入氯水
有白色沉淀生成
完成上述反应的离子方程式.
-
(4) ④中棉花团的作用是.
-
(5) 上述实验结束后,发现①中试管内有少量白色固体出现,冷却后将试管中的物质缓缓倒入水中,溶液呈蓝色.取少量蓝色溶液于试管中,滴加NaOH溶液至过量,出现的现象是.
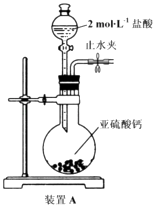
-
(1) 装置A中反应的化学方程式为
-
(2) 设计实验:利用装置1中产生的气体证明+4价硫具有氧化性
-
(3) 选用下面的装置和药品探究亚硫酸与次氯酸的酸性强弱
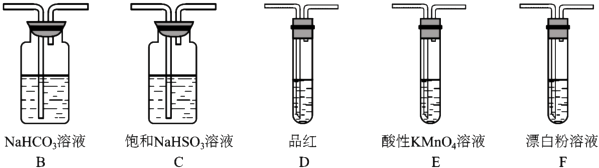
装置连接顺序为A,C,,,D,F,其中装置C的作用是,通过现象即可证明亚硫酸的酸性强于次氯酸
-
(4) 利用G装置可测定装置A残液中SO2的含量,量取1.00mL残夜于烧瓶中,加适量的水稀释,加热使SO2全部溢出并与锥形瓶中H2O2完全反应SO2+H2O2=H2SO4然后用0.1000mol/L﹣1NaOH标准溶液进行滴定,至终点时消耗NaOH溶液20.00mL.
①图G中球形冷凝管进水口为(填“a”或“b”)
②残液中SO2含量为 g.L﹣1
③经过多次测定发现,测定值始终高于实际值,则其原因是.


-
(1) 若用A装置做乙醇与乙酸的酯化反应实验,则还需连接的装置是(填序号),该装置中应加入试剂.从实验安全角度考虑,A装置试管中除加入反应液外,还需加入的固体物质是.
-
(2) 该小组同学欲做乙醇氧化成乙醛的实验,则应选用的装置是(填序号),再用制得的乙醛溶液进行银镜反应,正确的操作顺序是(填序号).
①向试管中滴入3滴乙醛溶液
②一边振荡一边滴入2%的稀氨水,直至最初产生的沉淀恰好溶解为止
③振荡后放入热水中,水浴加热
④在洁净的试管中加入1mL 2%的AgNO3溶液.
| 实验 | 序号 | c(CaCl2)(mol·L-1) | 滴加CaCl2溶液时的 实验现象 | 加热浑浊液时的 实验现象 |
| | ① | 0.05 | 至1.32 mL时产生明显浑浊,但无气泡产生 | 有较多气泡生成 |
| ② | 0.005 | 至15.60 mL时产生明显浑浊,但无气泡产生 | 有少量气泡生成 | |
| ③ | 0.0005 | 至20 mL未见浑浊 |

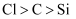 B . 用图2所示装置吸收氨气,并防止倒吸
C . 用图3所示装置制备并收集少量
B . 用图2所示装置吸收氨气,并防止倒吸
C . 用图3所示装置制备并收集少量  气体
D . 用图4所示装置制备少量氧气
气体
D . 用图4所示装置制备少量氧气
| A | B | C | D | |
| 实验方案 | | | | |
| 实验目的 | 验证化学能可以转化成电能 | 实验室利用该装置制备少量氯气 | 验证非金属性: Cl>C>Si | 加热至混合液呈红褐色,停止加热,制备Fe(OH)3胶体 |
 >Cl2>Fe3+>I2
B . 上述实验中共有两个氧化还原反应
C . 实验①生成的气体不能使湿润的KI试纸变蓝
D . 实验②证明Fe2+既有氧化性又有还原性
>Cl2>Fe3+>I2
B . 上述实验中共有两个氧化还原反应
C . 实验①生成的气体不能使湿润的KI试纸变蓝
D . 实验②证明Fe2+既有氧化性又有还原性
 Ti原子核内中子数比质子数多4
Ti原子核内中子数比质子数多4
 常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示:
常用作杀虫剂、媒染剂,某小组在实验室以铜为主要原料合成该物质的路线如图所示: 已知:①
已知:① 为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
为绛蓝色晶体,在溶液中存在以下电离(解离)过程:
 、
、 。
。
② 和
和 在水中均可溶,在乙醇中均难溶。若向
在水中均可溶,在乙醇中均难溶。若向 溶液中加入乙醇,会析出
溶液中加入乙醇,会析出 晶体。
晶体。
请回答下列问题:
-
(1) 实验室用下图装置制备合成
 所需的
所需的 溶液。
溶液。
①仪器a的名称是;仪器d中发生反应的离子方程式是。
②说明检验装置A气密性的方法:。
③装置B的加热方法为水浴加热,其优点是。
-
(2) 方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
该方案存在一定缺陷,因为根据该方案得到的产物晶体中往往含有__(填化学式)杂质,其原因是__(从平衡移动的角度回答)。
-
(3) 方案2的实验步骤为:向
 溶液中加入适量(填试剂名称),过滤、洗涤、干燥。
溶液中加入适量(填试剂名称),过滤、洗涤、干燥。
-
(4) 方案1、2中步骤均有过滤、洗涤、干燥。
①过滤的主要目的是将固液混合物进行分离。中学化学中常见的固液混合物分离的操作有“倾析法”、“普通过滤法”和“减压过滤法”等,操作示意图如下:

减压过滤法相对于普通过滤法的优点为(填序号,下同)。
A.过滤速度相对较快 B.能过滤胶体类混合物 C.得到的固体物质相对比较干燥
②下列最适合在“洗涤”步骤中作为洗涤液的是。
A.蒸馏水 B.乙醇与水的混合液 C.饱和(NH4)2SO4溶液
 氧化,是一种潜在的锂电池的电解质材料。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备
氧化,是一种潜在的锂电池的电解质材料。实验室用粗锌(含少量铜、FeS)和稀硫酸反应制备 , 并用制得的
, 并用制得的 去还原硫酸锂制备硫化锂,反应原理:
去还原硫酸锂制备硫化锂,反应原理: , 实验装置如图所示。请回答下列问题:
, 实验装置如图所示。请回答下列问题:
-
(1) 选择A装置实现随制随停,还适用于下列试剂制备对应气体的是(填标号)。
a.
 70%硫酸、亚硫酸钠 b.
70%硫酸、亚硫酸钠 b. :稀盐酸、大理石
:稀盐酸、大理石c.
 :浓氨水、生石灰 d.
:浓氨水、生石灰 d. :浓盐酸、
:浓盐酸、
-
(2) C和E装置中盛装的试剂相同,均可选择(填名称),E装置的作用是。
-
(3) B装置中发生反应的离子方程式为。
-
(4) 得到的
 产品中往往含有一定量的杂质,某小组同学对产品中的杂质进行探究。
产品中往往含有一定量的杂质,某小组同学对产品中的杂质进行探究。①提出猜想:
猜想一:产品中含杂质

猜想二:产品中含杂质

猜想三:产品中含杂质S
依据所学知识,猜想三不成立,理由是。
②化学小组为验证猜想:
限选试剂:稀盐酸、稀硫酸、蒸馏水、品红溶液、双氧水、氯化钡溶液、硝酸钡溶液
实验
操作与现象
结论
I
取少量
 样品溶于水,
样品溶于水,样品中不含

II
在实验I反应后的溶液中,
样品中含

-
(5) 测定产品纯度的方法:取wg样品加入足量
 稀硫酸,充分反应后,煮沸溶液,冷却后滴加酚酞溶液作指示剂,用
稀硫酸,充分反应后,煮沸溶液,冷却后滴加酚酞溶液作指示剂,用 NaOH标准溶液滴定,消耗NaOH标准溶液
NaOH标准溶液滴定,消耗NaOH标准溶液 。
。①煮沸的目的是。
②样品的纯度为。
实验 | 装置 | 试剂a | 现象 |
① |
| 紫色的石蕊试液 | 溶液先变红后褪色 |
② |
| 产生气泡 | |
③ |
| 产生白色沉淀 | |
④ |
| 溶液变蓝 |
 、
、 B . 实验②发生的反应为:
B . 实验②发生的反应为: C . 实验③说明新制氯水中有
C . 实验③说明新制氯水中有 ,
,  D . 实验④发生的反应为:
D . 实验④发生的反应为:




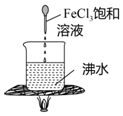

 溶液
溶液 酸化的
酸化的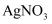 溶液
溶液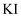 溶液、淀粉溶液
溶液、淀粉溶液


