第2章 元素与物质世界 知识点题库
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A . 加入铝粉能放出氢气的溶液中:Na+、Mg2+、Cl-、  B . 由水电离出的c(OH-)=1.0×10-13mol/L的溶液中:
B . 由水电离出的c(OH-)=1.0×10-13mol/L的溶液中:  、I-、Ca2+、
、I-、Ca2+、  C . 0.1mol/LNH4HCO3溶液中:K+、Na+、
C . 0.1mol/LNH4HCO3溶液中:K+、Na+、  、Br-
D . 使甲基橙变红的溶液中:
、Br-
D . 使甲基橙变红的溶液中:  、K+、Fe2+、
、K+、Fe2+、 
 B . 由水电离出的c(OH-)=1.0×10-13mol/L的溶液中:
B . 由水电离出的c(OH-)=1.0×10-13mol/L的溶液中:  、I-、Ca2+、
、I-、Ca2+、  C . 0.1mol/LNH4HCO3溶液中:K+、Na+、
C . 0.1mol/LNH4HCO3溶液中:K+、Na+、  、Br-
D . 使甲基橙变红的溶液中:
、Br-
D . 使甲基橙变红的溶液中:  、K+、Fe2+、
、K+、Fe2+、 
下列有关资源的开发利用的说法正确的是( )
A . 海水提取溴的过程中不发生氧化还原反应
B . 全球“低碳”行动能减少CO2的排放量,从而降低酸雨的形成及危害
C . 从海带中提取碘单质的过程一定涉及氧化还原反应
D . 石油的分馏、煤的气化、海水晒盐、从花生中提取花生油等过程都是物理变化
实验室制  的反应为
的反应为  ,下列说法错误的是( )
,下列说法错误的是( )
 的反应为
的反应为  ,下列说法错误的是( )
,下列说法错误的是( )
A . 还原剂是  ,氧化剂是
,氧化剂是  B . 每消耗1mol
B . 每消耗1mol  ,起还原作用的
,起还原作用的  消耗4mol
C . 每生成1mol
消耗4mol
C . 每生成1mol  ,转移电子的物质的量为2mol
D . 生成的
,转移电子的物质的量为2mol
D . 生成的  中,除含有一些水蒸气外,还含有杂质
中,除含有一些水蒸气外,还含有杂质 
 ,氧化剂是
,氧化剂是  B . 每消耗1mol
B . 每消耗1mol  ,起还原作用的
,起还原作用的  消耗4mol
C . 每生成1mol
消耗4mol
C . 每生成1mol  ,转移电子的物质的量为2mol
D . 生成的
,转移电子的物质的量为2mol
D . 生成的  中,除含有一些水蒸气外,还含有杂质
中,除含有一些水蒸气外,还含有杂质 
某无色透明溶液中可能大量存在的阳离子为Ag+、Mg2+、Cu2+、Fe2+、Na+中的几种,请回答下列问题:(用离子符号填空)
-
(1) 不做任何实验就可以确定原溶液中不存在的离子是 。
-
(2) 取少量溶液,加入过量盐酸,有白色沉淀生成;再加入过量稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是 。
-
(3) 取(2)中的滤液,加入过量稀氨水,出现白色沉淀,说明原溶液中肯定存在的离子是。有关的离子方程式是。
-
(4) 原溶液可能大量存在的阴离子是 __________________(填字母)。A . Cl- B .
 C .
C .  D . OH-
D . OH-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A . 无色透明的溶液中:  、
、  、
、  、
、  B . 在中性溶液中:
B . 在中性溶液中:  、
、  、
、  、
、  C . 使甲基橙变红的溶液中:
C . 使甲基橙变红的溶液中:  、
、  、
、  、
、  D .
D . 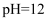 的溶液中:
的溶液中:  、
、  、
、  、
、 
 、
、  、
、  、
、  B . 在中性溶液中:
B . 在中性溶液中:  、
、  、
、  、
、  C . 使甲基橙变红的溶液中:
C . 使甲基橙变红的溶液中:  、
、  、
、  、
、  D .
D . 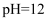 的溶液中:
的溶液中:  、
、  、
、  、
、 
关于CuSO4溶液和Fe(OH)3胶体描述正确的是( )
A . 两者颜色不一样
B . 两者外观上都不透明
C . 两者都能产生丁达尔现象
D . 两者不能产生丁达尔现象
3C+2K2Cr2O7+8H2SO4(稀) 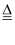 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
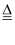 3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O
-
(1) 用双线桥标出电子转移的方向和数目。
-
(2) 此反应的氧化剂是,还原剂是。
下列离子方程式中正确的是( )
A . 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B . 氢氧化钡与硫酸铜反应:OH-+H+=H2O
C . 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D . 氯化镁溶液与氢氧化钠溶液反应:Mg2++2OH-=Mg(OH)2↓
下列属于氧化还原反应的是( )
A . NH4Cl+NaOH  NH3↑+NaCl+H2O
B . MnO2+4HCl(浓)
NH3↑+NaCl+H2O
B . MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
C . Na2O2+2H2O=2NaOH+H2O2
D . SO2+H2O=H2SO3
MnCl2+Cl2↑+2H2O
C . Na2O2+2H2O=2NaOH+H2O2
D . SO2+H2O=H2SO3
 NH3↑+NaCl+H2O
B . MnO2+4HCl(浓)
NH3↑+NaCl+H2O
B . MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
C . Na2O2+2H2O=2NaOH+H2O2
D . SO2+H2O=H2SO3
MnCl2+Cl2↑+2H2O
C . Na2O2+2H2O=2NaOH+H2O2
D . SO2+H2O=H2SO3
下列关于化学反应及相关概念的叙述正确的是( )
A . 碱性氧化物一定是金属氧化物
B . 溶于水能导电的化合物一定是电解质
C . 酸性氧化物都是非金属氧化物
D . 有单质生成的反应一定是氧化还原反应
现有以下物质:①NaCl晶体 ②稀盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜⑦CO2 ⑧冰醋酸 ⑨液氯 ⑩SO2 ⑪石墨
-
(1) 以上物质中能导电的是。
-
(2) 以上物质中属于电解质的是,属于非电解质的是。
-
(3) 以上物质中属于弱电解质的是,属于强电解质的是。
下列离子方程式正确的是( )
A . 金属铜与稀硝酸反应:3Cu+8H++2NO  =3Cu2++2NO↑+4H2O
B . 氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+
C . 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++2H2O2+4H+=2Fe3++4H2O
D . 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO
=3Cu2++2NO↑+4H2O
B . 氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+
C . 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++2H2O2+4H+=2Fe3++4H2O
D . 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO 
 =3Cu2++2NO↑+4H2O
B . 氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+
C . 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++2H2O2+4H+=2Fe3++4H2O
D . 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO
=3Cu2++2NO↑+4H2O
B . 氯化铁和铜反应:Fe3++Cu=Fe2++Cu2+
C . 硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++2H2O2+4H+=2Fe3++4H2O
D . 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO 
现有下列物质:①K2SO4晶体;②液态SO3;③冰醋酸;④铜;⑤小苏打;⑥蔗糖;⑦乙醇;⑧熔融的氯化钠;⑨NaOH溶液。其中:能导电的是(填序号,下同);属于电解质的是;属于非电解质的是;属于强电解质的是;属于弱电解质的电离方程式为。
在探究“不同价态含硫物质的转化”实验中,某实验小组选定“-2→0硫元素的转化”进行探究。
-
(1) 小方拟用H2O2与H2S反应,则氧化剂与还原剂的物质的量之比为。
-
(2) 小明结合已有知识,计划选用Cl2与H2S反应。在讨论设计实验方案时,小组同学提出两种方案:
方案I:用干燥Cl2与H2S反应
方案II:用潮湿的Cl2与H2S反应
小组同学设计了以下实验装置并动手实验、验证方案:
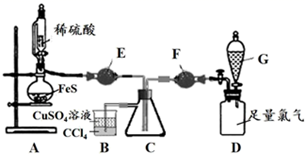
①证明以上装置气密性良好的具体操作是。
②仪器E的名称是。
③装置B的作用是。(答2点)
实验序号
实验操作
实验现象
结论
I
滴加稀硫酸,使H2S充满C瓶④ , 再打开G中的旋塞,缓慢通入Cl2至过量⑤。
C中有淡黄色固体产生,Cl2通入过量,淡黄色固体不消失。
淡黄色固体为单质硫,不会与过量的氯气反应。
II
撤去E、F装置,在C中加入少量水,先向C瓶通入H2S,再通入Cl2至过量。
C中看到淡黄色浑浊,通入Cl2过量,淡黄色沉淀消失⑥。
有水存在时,淡黄色固体会与过量氯气进一步反应。
④E中的试剂是。先通H2S排出装置中的空气,证明H2S已充满的现象是 (用离子方程式表示)。
⑤G中的试剂是。通过什么现象判断氯气已过量?。
⑥分析与讨论:实验II中黄色沉淀消失是S元素转变成了 (填离子符号),证明推测合理的实验操作和现象是:。
实验结论:-2→0硫元素的转化,氧化剂的选择、用量和反应环境均会影响结果。
一种发光二极管连接柠檬电池装置如图所示。下列说法正确的是( )

A . 该装置实现了电能转化为化学能
B . 电子由铜线经发光二极管流向铁环
C . 负极的电极反应:
 D . 可将柠檬替换成盛装酒精的烧杯
D . 可将柠檬替换成盛装酒精的烧杯

 D . 可将柠檬替换成盛装酒精的烧杯
D . 可将柠檬替换成盛装酒精的烧杯
常温下,下列各组离子在指定溶液中能大量共存的是( )
A .  溶液中:
溶液中:  、
、  、
、  、
、  B . 无色透明的溶液中:
B . 无色透明的溶液中:  、
、  、
、  、
、  C . 使酚酞变红的溶液中:
C . 使酚酞变红的溶液中:  、
、  、
、  、
、  D .
D .  的溶液:
的溶液:  、
、  、
、  ,
, 
 溶液中:
溶液中:  、
、  、
、  、
、  B . 无色透明的溶液中:
B . 无色透明的溶液中:  、
、  、
、  、
、  C . 使酚酞变红的溶液中:
C . 使酚酞变红的溶液中:  、
、  、
、  、
、  D .
D .  的溶液:
的溶液:  、
、  、
、  ,
, 
化学与生产、生活密切相关,下列说法错误的是( )
A . “凡铁分生熟,出炉未炒则生,既炒则熟”中的“炒”为氧化除碳过程
B . 暖宝宝主要含有铁粉、水、活性炭、食盐等,其原理是利用铁粉与水反应放热
C . 用CO2人工合成淀粉,有利于减少农药化肥污染和促进“碳中和”
D . “化干戈为玉帛”中的“帛”主要成分是蛋白质,一定条件下水解生成氨基酸
向Fe和Al2O3的混合物中加入足量稀硫酸将其溶解,室温下向所得溶液中加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
A . 通入过量Cl2: Cl-、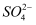 、Fe2+、Al3+
B . 加入过量氨水:NH4+、
、Fe2+、Al3+
B . 加入过量氨水:NH4+、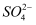 、Na+、
、Na+、 C . 加入过量NaOH溶液:
C . 加入过量NaOH溶液: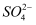 、Na+、
、Na+、 、OH-
D . 加入过量NaNO3溶液:NO3-、
、OH-
D . 加入过量NaNO3溶液:NO3-、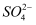 、Fe2+、Al3+
、Fe2+、Al3+
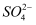 、Fe2+、Al3+
B . 加入过量氨水:NH4+、
、Fe2+、Al3+
B . 加入过量氨水:NH4+、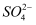 、Na+、
、Na+、 C . 加入过量NaOH溶液:
C . 加入过量NaOH溶液: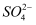 、Na+、
、Na+、 、OH-
D . 加入过量NaNO3溶液:NO3-、
、OH-
D . 加入过量NaNO3溶液:NO3-、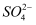 、Fe2+、Al3+
、Fe2+、Al3+
在一定量铁的氧化物中,加入45mL 4 mol∙L−1硫酸溶液恰好完全反应,所得溶液中的 恰好能被标准状况下
恰好能被标准状况下 氯气氧化。则该固体中铁原子和氧原子的个数比为( )
氯气氧化。则该固体中铁原子和氧原子的个数比为( )
 恰好能被标准状况下
恰好能被标准状况下 氯气氧化。则该固体中铁原子和氧原子的个数比为( )
氯气氧化。则该固体中铁原子和氧原子的个数比为( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
某研究性学习组利用 溶液和酸性
溶液和酸性 溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
 溶液和酸性
溶液和酸性 溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:实验序号 | 实验温度 |
|
|
| 溶液褪色时间 | ||
V(mL) | c(mol/L) | V(mL) | c(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
-
(1) 通过实验A、B,可探究出的改变对反应速率的影响,其中V1=,T1=K,通过实验C和可探究出温度变化对化学反应速率的影响。
-
(2) 若
 , 则由实验A、B可以得出的结论是;利用实验B中数据计算,从反应开始到结束,用
, 则由实验A、B可以得出的结论是;利用实验B中数据计算,从反应开始到结束,用 的浓度变化表示的反应速率是mol/(L·s)。
的浓度变化表示的反应速率是mol/(L·s)。
-
(3) 该反应有
 和无毒气体产生,则该反应的离子方程式是。
和无毒气体产生,则该反应的离子方程式是。
最近更新




