第2章 元素与物质世界 知识点题库
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不属于氧化还原反应的是( )
A . 钢铁生锈
B . 燃放鞭炮
C . 食物腐败
D . 海水晒盐
下列物质中,按只有氧化性、只有还原性、既有氧化性又有还原性的顺序排列的一组是( )
A . Cu2+、K、HCl
B . Cl2、Al、H2
C . NO2、Na、Cl2
D . O2、SO2、H2O
下列有关氧化物的说法正确的是( )
A . CO属于酸性氧化物
B . 氧化物中氧元素一定为-2价
C . 大多数金属氧化物属于碱性氧化物
D . 碱性氧化物与酸反应不一定生成盐和水
下列物质属于酸性氧化物的是( )
A . Al2O3
B . Na2O2
C . NO
D . CO2
2020年新春之际,出现了罕见的新型冠状病毒肺炎,威胁着人们的身体健康。以下消毒剂可以有效地灭活病毒,走进了百姓的生活中。下列叙述中,错误的是( )
A . 高锰酸钾(KMnO4)是电解质
B . H2O2分子中所有原子都达到了8电子结构
C . 次氯酸钠(NaClO)是离子化合物
D . 医用酒精是体积分数为75%的乙醇溶液
下列物质属于非电解质的是( )
A . 盐酸
B . 蔗糖
C . NaOH
D . 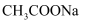
 是一种高效的漂白剂,实验室中一种制备
是一种高效的漂白剂,实验室中一种制备  的过程如图所示,下列说法错误的是( )
的过程如图所示,下列说法错误的是( ) 
A .  的漂白原理与
的漂白原理与  不同
B . 每生成1 mol
不同
B . 每生成1 mol  有0.5 mol
有0.5 mol  被氧化
C . 反应2过程中,
被氧化
C . 反应2过程中,  作氧化剂
D . 粗产品经重结晶可得到纯度更高的
作氧化剂
D . 粗产品经重结晶可得到纯度更高的 
 的漂白原理与
的漂白原理与  不同
B . 每生成1 mol
不同
B . 每生成1 mol  有0.5 mol
有0.5 mol  被氧化
C . 反应2过程中,
被氧化
C . 反应2过程中,  作氧化剂
D . 粗产品经重结晶可得到纯度更高的
作氧化剂
D . 粗产品经重结晶可得到纯度更高的 
下列食品添加剂与类别对应不正确的一组是( )
A . 着色剂——柠檬黄、焦糖色
B . 防腐剂——苯甲酸钠、山梨酸钾
C . 增味剂——亚硝酸钠、谷氨酸钠
D . 营养强化剂——食盐加碘酸钾、奶粉加维生素
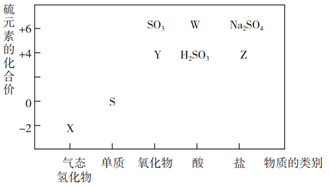
物质的类别和元素的化合价是研究物质性质的两个重要角度。请根据如图所示,回答下列问题:
-
(1) 欲制备Na2S2O3 , 从氧化还原角度分析,合理的是(填序号)。
a.Na2S+S b.SO2+Na2SO4 c.Na2SO3+Na2SO4 d.Na2SO3+S
-
(2) 将X与Y混合使之充分反应,该反应的氧化产物与还原产物质量之比为。
-
(3) 图为铜丝与W的浓溶液反应并验证其产物性质的实验装置。
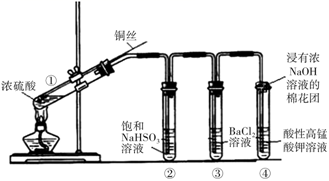
I.①中反应的化学方程式是。想要立即终止①的反应,最恰当的方法是。
a.上移铜丝,使其脱离溶液
b.撤去酒精灯
c.拔去橡胶塞倒出溶液
II.装置④溶液中的现象为,发生的离子反应方程式。
III.反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式。
已知酸式盐NaHB在水溶液中存在下列变化:①NaHB=Na++HB- , ②HB-  H++B2- , ③HB-+H2O
H++B2- , ③HB-+H2O  H2B+OH- , 且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
H2B+OH- , 且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
 H++B2- , ③HB-+H2O
H++B2- , ③HB-+H2O  H2B+OH- , 且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
H2B+OH- , 且溶液中c(B2-)>c(H2B),则下列说法一定正确的是( )
A . 0.01 mol·L-1的NaHB溶液,其pH可能为2
B . NaHB及H2B均为强电解质
C . 该酸式盐溶液中水电离出的氢离子浓度小于纯水中水电离出的氢离子浓度。
D . HB-的电离程度小于HB-的水解程度
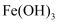 胶体在生活中有重要应用,利用
胶体在生活中有重要应用,利用  和沸水反应制备的
和沸水反应制备的 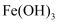 胶体中常混有
胶体中常混有  和HCl。已知胶体不能透过半透膜,而小分子和离子可以透过半透膜。试回答下列有关问题:
和HCl。已知胶体不能透过半透膜,而小分子和离子可以透过半透膜。试回答下列有关问题:
-
(1) 制取
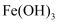 胶体的实验操作是。用的方法除去胶体中的浑浊物;用(填方法或现象)证明胶体已经制成。
胶体的实验操作是。用的方法除去胶体中的浑浊物;用(填方法或现象)证明胶体已经制成。
-
(2)
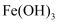 胶体区别于
胶体区别于  溶液的本质特征是。
溶液的本质特征是。
-
(3) 除去胶体中混有的
 和HCl的实验操作名称是。
和HCl的实验操作名称是。
-
(4) 取半透膜外最后一次的溶液少许于试管中,,则证明胶体和
 已经完全分离。
已经完全分离。
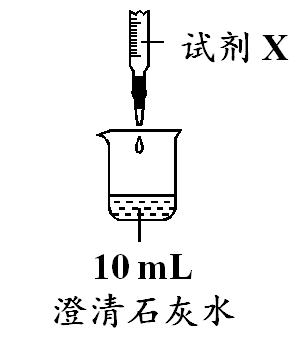
下列离子方程式书写正确的是( )
A . 向  溶液中通入足量
溶液中通入足量  :
:  B . 将过量的镁粉加入氯化铁溶液中:
B . 将过量的镁粉加入氯化铁溶液中:  C . 向偏铝酸钠溶液中滴加过量的
C . 向偏铝酸钠溶液中滴加过量的  溶液:
溶液:  D . 澄清石灰水与
D . 澄清石灰水与 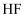 反应:
反应: 
 溶液中通入足量
溶液中通入足量  :
:  B . 将过量的镁粉加入氯化铁溶液中:
B . 将过量的镁粉加入氯化铁溶液中:  C . 向偏铝酸钠溶液中滴加过量的
C . 向偏铝酸钠溶液中滴加过量的  溶液:
溶液:  D . 澄清石灰水与
D . 澄清石灰水与 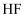 反应:
反应: 
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A . 氢氧化钠与盐酸;氢氧化钠与碳酸
B . Al2O3与硫酸反应;Al2O3与盐酸
C . Na2CO3溶液与硝酸溶液;CaCO3溶液与硝酸溶液
D . BaCl2溶液与Na2SO4溶液;Ba(OH)2溶液与H2SO4溶液
2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
-
(1) ①写出实验室中制取氯气的离子方程式;
②已知KMnO4与浓盐酸反应的化学方程式如下,该反应也可以用来制取氯气:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,15.8g KMnO4能和 gHCl发生上述反应、其中有molHCl被氧化、产生的Cl2在标准状况下的体积为L;
③实验室还可以利用如下反应制取氯气:KClO3+6HCl(浓)= KCl+3Cl2↑+3H2O。若制取标准状况下6.72L氯气,反应过程中转移电子的物质的量为;
-
(2) 常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO 是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用 :
①浸泡衣物时加入“84”消毒液在空气中放置一段时间漂白效果更好,原因用离子方程式表示为:;(已知酸性:H2CO3 >HClO>
 )
) ②某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与
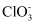 的个数比为1∶3,写出该反应的化学方程式:;
的个数比为1∶3,写出该反应的化学方程式:; -
(3) 世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为Cl- , ClO2的消毒效率是氯气的倍。
二氧化氯(ClO2)是国际上公认的安全、无毒、绿色消毒剂和去污剂,可用于饮用水和环境的消毒杀菌处理,可以除去水体或环境中的氰化物污染等,除去氰化物污染的反应原理2ClO2+2CN-=2CO2+N2+2Cl-。下列关于该反应的说法错误的是( )
A . 氧化剂只有ClO2
B . 氧化剂与还原剂的物质的量之比为1:1
C . 氧化产物只有CO2
D . 转移1 mol电子时,理论上生成6.72L(标准状况)气体
-
(1) CH4的空间构型呈(用文字描述)。
-
(2) 0.5molO2的质量为g,在标准状况下的体积约为L,同温同压下,O2和O3的密度之比为。
-
(3) 氧元素的一种核素,核内有10个中子,该核素的符号可表示为。
-
(4) KClO3在水中的电离方程式是。
-
(5) 用单线桥法标出下列反应电子转移的方向和数目:。
6Fe2++Cr2O
 +14H+=6Fe3++2Cr3++7H2O
+14H+=6Fe3++2Cr3++7H2O
镁元素又称“国防元素”,可用于制造汽车、飞机、火箭等,目前世界上60%的镁是从海水提取的。海水提镁的主要流程如图:

其中说法正确的是( )
A . 上面反应涉及到四大基本反应和氧化还原反应
B . 从MgCl2·6H2O到MgCl2的变化是物理变化
C . 过滤需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
D . 反应①的离子方程式为:Mg2++2OH-=Mg(OH)2↓
小组探究Na2CO3和NaHCO3与碱的反应,实验过程及结果如下。
实验装置 | 试剂X | 实验结果 | ||
| I | II | III | ①II、III均产生白色沉淀 ②烧杯中溶液pH变化如下
|
蒸馏水 | 0.05mol·L−1 Na2CO3溶液 | 0.05mol·L−1 NaHCO3溶液 | ||
已知:pH越大,c(OH-)越大,溶液碱性越强。
下列说法不正确的是( )
A . I是空白实验,排除因体积变化对II、III溶液pH的影响
B . II和I的pH曲线基本重合,说明 与OH−不反应,II中发生反应:
与OH−不反应,II中发生反应: +Ca2+=CaCO3↓
C . III比II的pH曲线降低,说明
+Ca2+=CaCO3↓
C . III比II的pH曲线降低,说明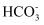 与OH−反应,III中初期发生反应:
与OH−反应,III中初期发生反应: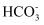 +OH−+Ca2+=CaCO3↓+H2O
D . III中石灰水恰好完全反应时,溶液pH=7
+OH−+Ca2+=CaCO3↓+H2O
D . III中石灰水恰好完全反应时,溶液pH=7
 与OH−不反应,II中发生反应:
与OH−不反应,II中发生反应: +Ca2+=CaCO3↓
C . III比II的pH曲线降低,说明
+Ca2+=CaCO3↓
C . III比II的pH曲线降低,说明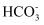 与OH−反应,III中初期发生反应:
与OH−反应,III中初期发生反应: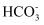 +OH−+Ca2+=CaCO3↓+H2O
D . III中石灰水恰好完全反应时,溶液pH=7
+OH−+Ca2+=CaCO3↓+H2O
D . III中石灰水恰好完全反应时,溶液pH=7
下列除杂的方法正确的是( )
A . 除去 中的少量
中的少量 :通过灼热的CuO粉末,收集气体
B . 除去
:通过灼热的CuO粉末,收集气体
B . 除去 中的少量HCl:通入过量NaOH溶液,收集气体
C .
中的少量HCl:通入过量NaOH溶液,收集气体
C . 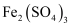 溶液
溶液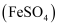 :通入足量的氯气
D .
:通入足量的氯气
D .  溶液
溶液 :加入过量铁粉,过滤
:加入过量铁粉,过滤
 中的少量
中的少量 :通过灼热的CuO粉末,收集气体
B . 除去
:通过灼热的CuO粉末,收集气体
B . 除去 中的少量HCl:通入过量NaOH溶液,收集气体
C .
中的少量HCl:通入过量NaOH溶液,收集气体
C . 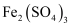 溶液
溶液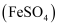 :通入足量的氯气
D .
:通入足量的氯气
D .  溶液
溶液 :加入过量铁粉,过滤
:加入过量铁粉,过滤
现有下列8种物质:①铜 ②稀硫酸 ③ ④硫酸铝固体 ⑤稀硝酸 ⑥
④硫酸铝固体 ⑤稀硝酸 ⑥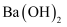 溶液 ⑦熔融的KCl ⑧氢氧化铁胶体,回答下列问题:
溶液 ⑦熔融的KCl ⑧氢氧化铁胶体,回答下列问题:
 ④硫酸铝固体 ⑤稀硝酸 ⑥
④硫酸铝固体 ⑤稀硝酸 ⑥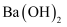 溶液 ⑦熔融的KCl ⑧氢氧化铁胶体,回答下列问题:
溶液 ⑦熔融的KCl ⑧氢氧化铁胶体,回答下列问题:
-
(1) 上述物质中,属于电解质的是(填标号);④溶于水的电离方程式为。
-
(2) 实验室制取⑧的离子方程式为;将②逐滴滴入⑧中至过量,可观察到的现象是。
-
(3) 上述物质中,有两种物质之间发生反应的离子方程式可表示为:
 , 则该反应的化学方程式为。
, 则该反应的化学方程式为。
最近更新