第2章 元素与物质世界 知识点题库


 、
、  、
、  、
、  、
、  、
、  、
、  、
、 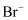 、
、  中的若干种.为检验其中含有的离子,进行如下实验:
中的若干种.为检验其中含有的离子,进行如下实验: ①取10mL溶液,加入足量氯水,无气体产生,再加入  溶液分层,下层为橙红色;
溶液分层,下层为橙红色;
②分液后,将①中上层溶液加入足量  和HCl溶液,产生白色沉淀
和HCl溶液,产生白色沉淀  ;
;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体.下列关于原溶液的说法正确的是( )
 、
、  、
、 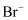 B . 是否存在
B . 是否存在  需要通过焰色反应来确定
C .
需要通过焰色反应来确定
C .  、
、  至少含有一种
D . 肯定不存在
至少含有一种
D . 肯定不存在  、
、  、
、  、
、 

 、
、  B . Fe2+、K+、
B . Fe2+、K+、  、
、  C . K+、Ca2+、
C . K+、Ca2+、  、
、  D . Na+、H+、
D . Na+、H+、  、
、 
|
实验一 |
现象 |
|
| 一段时间后,培养皿中由铜片向外侧依次呈现: A区澄清且几乎无色; B区底部覆盖棕黑色固体; C区澄清且紫色变浅 |
资料:a.  在酸性溶液中不能稳定存在:
在酸性溶液中不能稳定存在: 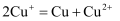
b. 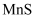 为粉红色沉淀、溶于强酸;
为粉红色沉淀、溶于强酸;  为黑色沉淀、不溶于强酸
为黑色沉淀、不溶于强酸
-
(1)
 被氧化成,依据是。
被氧化成,依据是。
-
(2) 为探究
 的还原产物,取A区中溶液(填操作和现象),证明有
的还原产物,取A区中溶液(填操作和现象),证明有  生成。
生成。
-
(3) A区中
 与
与  反应的离子方程式是。
反应的离子方程式是。
-
(4) 经检验,B区的棕黑色固体是
 ,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:。
,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:。
-
(5) 小组同学又进行了以下定量实验:
实验一
现象
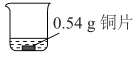

 酸性溶液
酸性溶液一段时间后,铜片质量减少了0.02g,溶液中无固体析出、溶液紫色变浅
通过计算,分析溶液紫色变浅而未完全褪色的原因:。

已知:As与P同为VA族元素;Ca3(AsO3)2微溶于水,Ca3(AsO4)2难溶于水。
下列说法错误的是( )
 氧化为
氧化为  B . 滤液①主要成分为NaOH溶液
C . 滤液②主要成分可以循环利用
D . “还原”的离子方程式:2H++2
B . 滤液①主要成分为NaOH溶液
C . 滤液②主要成分可以循环利用
D . “还原”的离子方程式:2H++2  +2SO2=2
+2SO2=2  +As2O3↓+H2O
+As2O3↓+H2O
 B . 亚硫酸氢钠的水解:
B . 亚硫酸氢钠的水解:  C . 锌溶于氢氧化钠溶液:
C . 锌溶于氢氧化钠溶液:  D . 亚硝酸钠与氯化铵溶液受热反应:
D . 亚硝酸钠与氯化铵溶液受热反应: 
 、Br-
B . 加入镁粉产生H2的溶液中:Cu2+、Na+、SO
、Br-
B . 加入镁粉产生H2的溶液中:Cu2+、Na+、SO  、CH3COO-
C . 酸性溶液中:K+、Mg2+、SO
、CH3COO-
C . 酸性溶液中:K+、Mg2+、SO  、Cl-
D . 滴加酚酞试剂显红色的溶液中:Na+、Fe2+、Cl-、NO
、Cl-
D . 滴加酚酞试剂显红色的溶液中:Na+、Fe2+、Cl-、NO 

 Fe(OH)3(胶体)+3HCl
B . 滤纸上残留的红褐色物质为Fe(OH)3固体颗粒
C . 在B区的深红褐色分散系为Fe(OH)3胶体
D . 进入C区的H+的数目为0.03NA
Fe(OH)3(胶体)+3HCl
B . 滤纸上残留的红褐色物质为Fe(OH)3固体颗粒
C . 在B区的深红褐色分散系为Fe(OH)3胶体
D . 进入C区的H+的数目为0.03NA

实验I:探究中和滴定原理
i.连接计算机、pH传感器等仪器并组装,如图1所示。
ii.向烧杯中加入20.00mL0.1000mol·L-1盐酸,放入磁子,置于搅拌器上。
iii.向50mL碱式滴定管中加入0.1000mol·L-1NaOH溶液,赶走气泡,并调零。
……
v.向小烧杯中逐滴加入NaOH溶液,得到图2中的pH变化曲线图。
-
(1) 实验I中步骤iii忽略赶气泡,滴定前有气泡,滴定过程中消失,则测得的结果(填“偏大”、“偏小”或“不变”)。
-
(2) 若实验I中使用指示剂指示终点,3种指示剂中不应选用的指示剂是。选用合适的指示剂进行食醋中的总酸量测定时,达到滴定终点的现象是。
实验II:测定废水水样的COD(即化学需氧量,以氧化1升水样中还原性物质所消耗的氧化剂的量为指标,折算成每升水样全部被氧化后,需要氧的毫克数,以mg/L表示。)
i取某湖水水样100.00mL,酸化后加入0.1000mol·L-1的K2Cr2O7溶液20.00mL,使水中的还原性物质完全被氧化(Cr2O
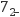 被还原为Cr3+);
被还原为Cr3+);ii再用1.000mol·L-1的FeSO4溶液滴定剩余的Cr2O
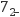 , 3次平行实验中消耗FeSO4溶液情况如下表。
, 3次平行实验中消耗FeSO4溶液情况如下表。序号
起始读数/mL
终点读数/mL
1
0.00
10.10
2
1.20
11.10
3
1.50
14.60
-
(3) 实验II中量取一定体积的K2Cr2O7溶液时,需要用(填“酸式”或“碱式”)滴定管;酸化水样时,应选用(填写所用酸的名称)酸化。
-
(4) 实验II步骤ii反应的离子方程式为。
-
(5) 水样的COD为mg/L。
-
(1) 补齐物质(或粒子)与其用途之间的连线。
物质(粒子) 用途
A.铝 a.制合金
B.四氧化三铁 b.测定文物年代
C.碳酸氢钠 c.作自来水消毒剂
D.14C d.作食用碱
E.氯气 e.作磁性材料
-
(2) 下列物质中① MgCl2 ②NaOH ③Na2O2 ④N2 ⑤H2S ⑥H2O2 ⑦CO2 ⑧CaO ⑨CH4 ⑩NH4Cl
只含有极性键的物质是(填序号,下同),既含有极性键又含有非极性键的物质是,既含有共价键又含有离子键的物质是 ,属于离子化合物的物质是,属于共价化合物的物质是。
-
(3) 我国古代四大发明之一的黑火药是由硫磺粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时反应为:S + 2KNO3 + 3C = K2S + N2↑ + 3CO2↑。在该反应中,还原剂是(填化学式),化合价升高;氧化剂是S和KNO3 , 被,发生 反应;当反应释放出33.6L(标准状况)的CO2气体时,转移电子数目为。
选项 | A | B | C | D |
强电解质 | NaNO3 | Cu | Ba(OH)2 | HCl |
弱电解质 | HF | H2SO4 | HClO | CH3COONH4 |
非电解质 | H2O | NH3 | CO2 | C2H5OH |

-
(1) Na2Fe4(SO4)6(OH)2中Fe的化合价为。
-
(2) “酸浸”时,Na2SO3的作用。“滤渣”的主要成分有SiO2和(填化学式)。“酸浸”中钌的浸出率与浸出温度、pH的关系如图所示,“酸浸”的最佳条件是。

-
(3) “除铁”的离子方程式为。(提示:1molNaClO3参与反应,转移6mol电子)
-
(4) 从“滤液2”中可提取一种化肥,其电子式为。
-
(5) “灼烧”时Ar的作用是。
-
(6) 某工厂用10t钌矿石[含8.84tRu(CO3)2、165kgRuO4],最终制得3636kgRu,则Ru的产率为。(保留三位有效数字)
-
(1) Ⅰ.金属及其化合物在人类生活、生产中发挥着重要的作用。印刷电路板由高分子材料和铜箔复合而成,刻制印刷电路时,工业上常用
 溶液作为“腐蚀液”,有
溶液作为“腐蚀液”,有 和
和 生成。如下是某工程师为了从使用过的腐蚀废液中回收铜并重新获得
生成。如下是某工程师为了从使用过的腐蚀废液中回收铜并重新获得 溶液所采用的工艺流程图:
溶液所采用的工艺流程图:
请回答下列问题。
实验室中,检验溶液中存在
 的试剂是溶液
的试剂是溶液 -
(2) 写出
 溶液与金属铜发生反应的离子方程式:。
溶液与金属铜发生反应的离子方程式:。
-
(3) 写出上述流程图中加入或生成的有关物质的化学式:①,④。
-
(4) Ⅱ.将5.4g的金属铝溶于足量的氢氧化钠溶液
发生反应的离子方程式为,产生的气体在标准状况下的体积为L。若将等质量的金属铝溶于足量的稀盐酸,则产生的气体在标准状况下的体积(填“相等”或“不相等”)
 、
、 、
、 、
、 B . 遇石蕊变红的溶液:
B . 遇石蕊变红的溶液: 、
、 、
、 、
、 C . 遇酚酞变红的溶液:
C . 遇酚酞变红的溶液: 、
、 、
、 、
、 D . 无色溶液:
D . 无色溶液: 、
、 、
、 、
、

 酸性溶液
酸性溶液


