第一章 打开原子世界的大门 知识点题库
下列分子的结构中,原子的最外层电子不能都满足8电子稳定结构的是( )
A . CO2
B . PCl3
C . CCl4
D . NO2
下列有关化学用语表示正确的是( )
A . 氮气的结构式:N=N
B . F﹣的结构示意图: 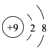 C . 中子数为20 的氯原子:2017Cl
D . NH3 的电子式:
C . 中子数为20 的氯原子:2017Cl
D . NH3 的电子式: 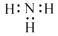
 C . 中子数为20 的氯原子:2017Cl
D . NH3 的电子式:
C . 中子数为20 的氯原子:2017Cl
D . NH3 的电子式:
下列化学用语正确的是( )
A . 醛基的电子式:  B . 对硝基甲苯的结构简式:
B . 对硝基甲苯的结构简式: 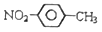 C . 1-丁烯的键线式:
C . 1-丁烯的键线式: 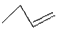 D . 聚丙烯的结构简式:
D . 聚丙烯的结构简式: 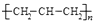
某元素的原子形成的离子可表示为abXn- , 有关说法错误的是( )
A . 中子数为a-b
B . 电子数为b+n
C . 质量数为a+b
D . 一个离子的质量约为 a/6.02×1023g
请用序号填空。
①35Cl和37Cl;②CH3CH2CH3和CH3CH2CH2CH3;③CH3-CH2-OH和CH3-O-CH3④ 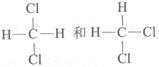
-
(1) 互为同位素的是;
-
(2) 互为同分异构体的是;
-
(3) 互为同系物的是。
A,B,C,D,E为原子序数依次增大的5种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B原子的最外层电子数是次外层电子数的两倍; C和E在周期表中相邻,且E的质子数是C的2倍。请回答下列问题:
-
(1) B位于第周期族;
-
(2) E的离子结构示意图是;DA中含有。(填化学键类型)
-
(3) BC2的电子式为;(用具体元素表示,下同)
-
(4) C、D、E三种元素简单离子的离子半径由大到小的顺序是。
硫及其化合物有许多用途,相关物质的物理常数如下表所示:
|
H2S |
S8 |
FeS2 |
SO2 |
SO3 |
H2SO4 |
|
|
熔点/℃ |
−85.5 |
115.2 |
>600(分解) |
−75.5 |
16.8 |
10.3 |
|
沸点/℃ |
−60.3 |
444.6 |
−10.0 |
45.0 |
337.0 |
回答下列问题:
-
(1) 基态O原子的电子排布图为,基态O原子电子占据最高能级的电子云轮廓图为形,O原子最外层电子的运动状态有种。
-
(2) 根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是。
-
(3) 图(a)为S8的结构,该分子中S原子的杂化轨道类型为。其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为。
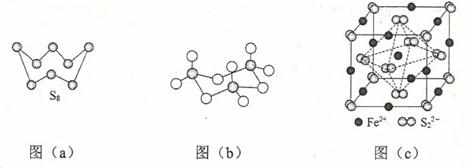
-
(4) 气态三氧化硫以单分子形式存在,其分子中共价键的类型有种(根据成键的方式);固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的价层电子数。
-
(5) FeS2晶体的晶胞如图(c)所示。晶胞中有Fe2+个,有S22-个,晶胞中Fe2+位于S22-所形成的的体心。
-
(6) 酸性H2SO4 H2SO3(填 “>”或 “<”)。
氨气电子式:,其分子空间构型是,氨气溶于水,溶液呈性,原因是(用化学方程式解释)。用玻璃棒蘸浓盐酸接触氨气时,观察到的现象为,发生的反应是(用化学方程式表示)。
H2S是一种具有气味的有毒气体,分子的电子式是,把H2S气体通入到CuSO4溶液中,现象是,反应的化学方程式。
下列说法正确的是( )
A . Na+和Mg2+核外电子排布相同,核外电子能量也相同
B . 已知钾在空气中燃烧的产物含有KO2 , KO2中各离子最外层均为8电子稳定结构
C . 二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D . C60Si60是一种新型的球形分子,经测定结构中包含C60也有Si60 , 则C60被包裹在Si60中
化学科学需要借助化学专用语言来描述,下列化学用语表达正确的是( )
A . 乙醇的结构简式:C2H6O
B . 氯离子的结构示意图: 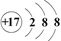 C . 羟基的电子式:
C . 羟基的电子式: 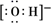 D . CH4分子的球棍模型:
D . CH4分子的球棍模型: 
相同物质的量的H2O和H2O2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1∶1
②它们所含的O原子数目之比为1∶2
③它们所含的原子总数目之比为3∶4
④它们所含的H原子数目之比为1∶1
⑤它们所含的电子数目之比为5∶9
A . ①②③④
B . ②和③
C . ④和⑤
D . ①②③④⑤
 是重要的工业原料,铀浓缩一直为国际社会关注。下列有关
是重要的工业原料,铀浓缩一直为国际社会关注。下列有关  的说法正确的是( )
的说法正确的是( )
A .  原子核中含有92个中子
B .
原子核中含有92个中子
B .  原子核外有143个电子
C .
原子核外有143个电子
C .  与
与  为同一核素
D .
为同一核素
D .  与
与  互为同位素
互为同位素
 原子核中含有92个中子
B .
原子核中含有92个中子
B .  原子核外有143个电子
C .
原子核外有143个电子
C .  与
与  为同一核素
D .
为同一核素
D .  与
与  互为同位素
互为同位素
下列有关化学用语表示正确的是( )
A . 乙醛的结构简式为CH3COH
B . 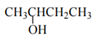 2-羟基丁烷
C . 羟基的电子式:
2-羟基丁烷
C . 羟基的电子式: 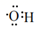 D . 对氯甲苯的结构简式:
D . 对氯甲苯的结构简式: 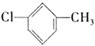
我国科学团队成功合成  和
和  ,下列关于两种离子的说法正确的是( )
,下列关于两种离子的说法正确的是( )
 和
和  ,下列关于两种离子的说法正确的是( )
,下列关于两种离子的说法正确的是( )
A . 1个  或
或  中均含有1个原子核
B . 两种离子可以组成离子化合物
C .
中均含有1个原子核
B . 两种离子可以组成离子化合物
C .  或
或  中N原子间以共用电子对结合
D . 数目相同的两种离子的电子数相差2个
中N原子间以共用电子对结合
D . 数目相同的两种离子的电子数相差2个
 或
或  中均含有1个原子核
B . 两种离子可以组成离子化合物
C .
中均含有1个原子核
B . 两种离子可以组成离子化合物
C .  或
或  中N原子间以共用电子对结合
D . 数目相同的两种离子的电子数相差2个
中N原子间以共用电子对结合
D . 数目相同的两种离子的电子数相差2个
中国科学家首次实现了两个异核原子(1个  原子和1个
原子和1个 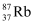 原子)的量子受控非门和量子纠缠,下列有关
原子)的量子受控非门和量子纠缠,下列有关 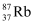 的说法正确的是( )
的说法正确的是( )
 原子和1个
原子和1个 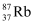 原子)的量子受控非门和量子纠缠,下列有关
原子)的量子受控非门和量子纠缠,下列有关 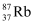 的说法正确的是( )
的说法正确的是( )
A . 质子数为87
B . 核外电子数为37
C . 中子数为37
D . 质量数为50
2020年12月17日,嫦娥五号探测器携带着珍贵的月球“土特产”——月壤成功返回,研究表明月壤包含微细的矿物颗粒、岩石碎屑和玻璃质微粒等,主要由氧、硅、铝、铁、镁钙、钠、钾、钛等元素构成。下列相关化学用语正确的是( )
A .  和
和  是氧的两种不同的同素异形体
B .
是氧的两种不同的同素异形体
B . 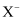 核外有m个电子、n个中子,X原子符号为
核外有m个电子、n个中子,X原子符号为 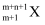 C . 钾原子的原子结构示意图为:
C . 钾原子的原子结构示意图为: 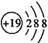 D . 一种月壤辉长岩成分为
D . 一种月壤辉长岩成分为 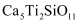 ,用氧化物的形式表示其组成为
,用氧化物的形式表示其组成为 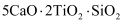
 和
和  是氧的两种不同的同素异形体
B .
是氧的两种不同的同素异形体
B . 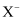 核外有m个电子、n个中子,X原子符号为
核外有m个电子、n个中子,X原子符号为 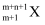 C . 钾原子的原子结构示意图为:
C . 钾原子的原子结构示意图为: 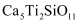 ,用氧化物的形式表示其组成为
,用氧化物的形式表示其组成为 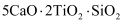
下列说法或有关化学用语的表达正确的是( )
A . 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B . 基态Fe原子的价电子轨道表示式 C . 因氧元素电负性比氮元素大,故氧元素第一电离能比氮元素第一电离能大
D . 基态铜原子的价层电子排布式为3d94s2
C . 因氧元素电负性比氮元素大,故氧元素第一电离能比氮元素第一电离能大
D . 基态铜原子的价层电子排布式为3d94s2
 C . 因氧元素电负性比氮元素大,故氧元素第一电离能比氮元素第一电离能大
D . 基态铜原子的价层电子排布式为3d94s2
C . 因氧元素电负性比氮元素大,故氧元素第一电离能比氮元素第一电离能大
D . 基态铜原子的价层电子排布式为3d94s2
利用“铁脱络-化学沉淀法”回收电镀废水中镍的流程如图。
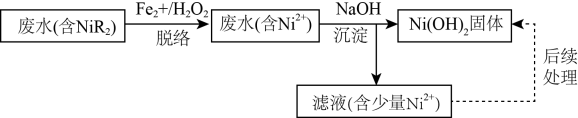
已知,①废水中镍主要以NiR2络合物形式存在,其在水溶液中存在平街:NiR2 (aq)  Ni2+ (aq)+ 2R- (aq,有机配体)K=1.6 ×10-14
Ni2+ (aq)+ 2R- (aq,有机配体)K=1.6 ×10-14
②常温下,Ksp[Fe(OH)3]=1×10-39 , Ksp[Ni(OH)2]=1. 6×10-15
③“脱络”(指NiR2转化成Ni2+ )过程中,反应历程如下:
i.Fe2++H2O2=Fe3++OH-+·OH;
ii.R-+·OH=OH-+ ·R;
iii. H2O2+2·OH=O2 ↑+2H2O。
-
(1) ·OH的电子式为。
-
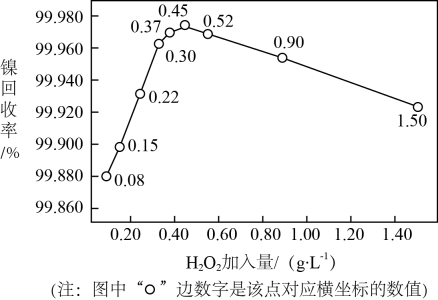
(2) ①根据·OH与H2O2的反应历程,分析“脱络”时加入的Fe2+的作用机制:。
②实验测得H2O2加入量对溶液中镍回收率的影响如图所示。由图可知,当加入H2O2的量为g·L-1时,镍回收效果最好;当加入H2O2的量较大时, 镍回收率下降,可能的原因是。
-
(3) 常温下,若“脱络”后的废水中 c(Ni2+ )=0. 01 mol·L-1 , “沉淀”时先加入 NaOH至溶液的pH= ,使Fe3+恰好沉淀完全(Fe3+浓度为10-6 mol·L-1 , 忽略溶液体积变化),此时 (填“有”或“无”)Ni(OH)2沉淀生成。
-
(4) 取100 mL某电镀废水利用上述流程回收镍,得到2. 325 g Ni(OH)2沉淀,经计算该步骤中Ni2+的回收率为99. 97%;Ni(OH)2沉淀再经稀硫酸溶解、、过滤,得到NiSO4·7H2O固体的质量为6.744g。试计算100mL该电镀废水中镍转化成NiSO4·7H2O的总回收率:(保留四位有效数字)。
发蓝工艺是将钢铁浸入热的NaNO2碱性溶液中,在其表面形成一层四氧化三铁薄膜。其中铁经历了如下转化:
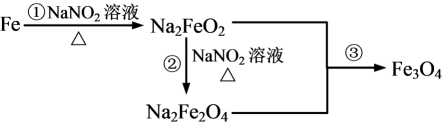
其中②的化学方程式为:Na2FeO2+NaNO2+H2O Na2Fe2O4+NH3↑+NaOH(未配平)。
Na2Fe2O4+NH3↑+NaOH(未配平)。
完成下列填空:
-
(1) Na原子核外有种能量不同的电子,其中能量最高的电子所占的电子亚层符号为。将反应②中涉及的短周期元素,按原子半径由大到小顺序排列。
-
(2) NH3分子的结构式为。从原子结构的角度解释氮元素的非金属性比氧元素弱的原因。
-
(3) 配平反应②的化学方程式。若反应生成11.2 L(标准状态)氨气,则电子转移的数目为。
-
(4) 反应③中Na2FeO2与Na2Fe2O4的物质的量之比为。写出Fe→Fe3O4的置换反应的化学方程式
最近更新



