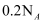第三节 物质的量 知识点题库

-
(1) 写出下列仪器的名称:a. b. c..
-
(2) 若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处.冷凝水由(填f或g)口通入.
-
(3) 现需配制0.1mol/L CuSO4溶液450mL,装置II是某同学转移溶液的示意图.
①图中的错误是.除图中给出的仪器和分析天平外,为完成实验还需的仪器有:.
②根据计算得知,需称取的胆矾的质量为 g.
③在100mL某浓度的CuSO4溶液中加入一质量为45.0g的铁棒,反应一段时间后,取出洗净,干燥后称量,称得质量变为46.6g.若反应后溶液的体积不变,所得溶液中FeSO4的物质的量浓度为 mol/L.
-
(1) 不需要用到的仪器有(填序号)
A 托盘天平 B 试管 C烧杯 D 玻璃棒 E 分液漏斗
F 500mL容量瓶 G 药匙 H 250mL容量瓶 I 胶头滴管
-
(2) 配制正确的操作顺序为(填序号)
A、计算:正确称量碳酸钠晶体的质量 B、定容:用胶头滴管加水至刻度线,摇匀 C、洗涤:用蒸馏水洗涤玻璃棒、烧杯2﹣3次,并将洗涤液转移至容量瓶中 D、溶解:将称量的碳酸钠晶体放入烧杯中,再加适量的水并用玻璃棒搅拌 E、转移:将冷却至室温的碳酸钠溶液,沿玻璃棒转入容量瓶中,摇匀
-
(3) 下列操作,会使得配制的结果偏小的是(填写编号).
A 称量时碳酸钠晶体与砝码的位置颠倒
B 使用容量瓶配制溶液时,俯视液面定容后所得溶液的浓度
C 没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D 容量瓶刚用蒸馏水洗净,没有烘干
E 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切.
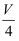 mL溶液稀释成4V mL后,SO42﹣的物质的量浓度为.
mL溶液稀释成4V mL后,SO42﹣的物质的量浓度为.
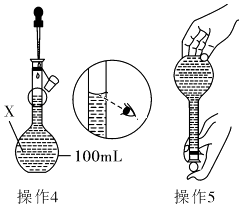
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解.
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中.
操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处.
操作4、操作5:见图
-
(1) 仪器X的名称是;
-
(2) 操作1中,应称取胆矾晶体的质量为;
-
(3) 若其余操作步骤均正确,根据操作4所配的溶液浓度 选填“偏大”、“偏小”、“不影响”或“无法判断”).
①将干燥的pH试纸浸到某溶液中,过一会取出与标准比色卡比较,测得该溶液的pH;
②用铂丝蘸取某溶液在酒精灯外焰上灼烧,直接观察火焰颜色来确认是否含有钾元素;
③通过丁达尔现象来区别硫酸铜溶液和氢氧化铁胶体;
④配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸;
⑤检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液即可.
的是( )
-
(1) 已知某硫酸溶液的的密度为1.84 g/cm3 , 质量分数为98%,该硫酸溶液的物质的量浓度为mol·L-1。
-
(2) 若将其稀释为500mL 0.2mol/L的溶液,需用量筒取该浓硫酸mL
-
(3) 焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将89 g焦硫酸溶于水配成800 mL硫酸,则该硫酸的物质的量浓度为mol·L-1。
-
(4) 硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:3FeS2+8 O2=Fe3O4+6SO2 , 4FeS2+11 O2=2Fe2O3+8SO2 , 若2.4 mol FeS2完全反应耗用氧气145.6 L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。
 2HNO3+4N2↑+9H2O反应中,生成28gN2 , 转移的电子数目为3.75NA
D . 反应N2(g)+3H2(g)⇌2NH3(g) △H=-92kJ/mol放出热量9.2kJ时,转移电子小于0.6NA
2HNO3+4N2↑+9H2O反应中,生成28gN2 , 转移的电子数目为3.75NA
D . 反应N2(g)+3H2(g)⇌2NH3(g) △H=-92kJ/mol放出热量9.2kJ时,转移电子小于0.6NA
-
(1) 在配制上述2.0mol·L-1NaCl溶液时,需要用到托盘天平,计算需要称取NaCl的质量为g(结果保留1位小数)。
-
(2) 下列操作对所配溶液浓度的影响是(填“偏高”“偏低”或“无影响”)。
操作
浓度影响
未将洗涤烧杯后的液体转移到容量瓶
①
定容时俯视
②
-
(3) 利用上述2.0mol·L-1NaCl溶液配制100mL0.5mol·L-1NaCl溶液(设为溶液A),用量筒量取所需2.0mol·L-1NaCl溶液的体积为mL(计算结果保留一位小数)。
-
(4) 某同学配制完KCl溶液后未洗涤烧杯,可能使用了同一个烧杯配制溶液A,其怀疑溶液A中混入了K+。该同学用焰色试验的方法,透过观察到火焰呈色,证明了溶液中含有K+。
-
(5) 某工厂用电解NaCl溶液的方法制备氯气,其化学原理为如下反应:
 H2O+
H2O+  NaCl
NaCl  Cl2↑+
Cl2↑+  NaOH+
NaOH+  ,请将上述方程式补充完整。
,请将上述方程式补充完整。
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
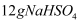 中含有
中含有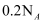 个阳离子
B .
个阳离子
B . 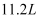 乙烷和丙烯的混合气体中所含碳氢键数为
乙烷和丙烯的混合气体中所含碳氢键数为 C .
C . 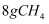 含有中子数为
含有中子数为 D .
D . 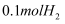 和
和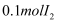 于密闭容器中充分反应后,
于密闭容器中充分反应后,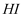 分子总数为
分子总数为