第дёүиҠӮ зү©иҙЁзҡ„йҮҸ зҹҘиҜҶзӮ№йўҳеә“
дёӢеҲ—жә¶ж¶Ідёӯж°ҜзҰ»еӯҗжө“еәҰдёҺ50mL 1molВ·L-1ж°ҜеҢ–й“қжә¶ж¶Ідёӯж°ҜзҰ»еӯҗжө“еәҰзӣёзӯүзҡ„жҳҜпјҲ пјү
A . 150mL 1molВ·L-1ж°ҜеҢ–й’ жә¶ж¶І
B . 75mL 2molВ·L-1зҡ„ж°ҜеҢ–й“өжә¶ж¶І
C . 150mL 3molВ·L-1зҡ„ж°ҜеҢ–й’ҫжә¶ж¶І
D . 75mL 1molВ·L-1зҡ„ж°ҜеҢ–дәҡй“Ғжә¶ж¶І
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҺдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . иҙЁйҮҸйғҪдёә4.4gзҡ„CH3CHOе’ҢCO2еҗ«жңүзҡ„еҲҶеӯҗж•°еқҮдёә0.1NA
B . 1molNa2O2дёӯзҡ„зҰ»еӯҗжҖ»ж•°дёә4NA
C . еҜҶй—ӯе®№еҷЁдёӯпјҢ2molSO2е’Ңи¶ійҮҸзҡ„O2еҸҚеә”иҪ¬з§»зҡ„з”өеӯҗж•°дёә4NA
D . 1molиӢҜеҲҶеӯҗдёӯжүҖеҗ«зҡ„зўізўіеҸҢй”®ж•°дёә3NA
еңЁеҗҢжё©еҗҢеҺӢдёӢпјҢз”ЁзӯүиҙЁйҮҸзҡ„H2гҖҒCH4гҖҒCO2гҖҒHClеӣӣз§Қж°”дҪ“еҲҶеҲ«еҗ№иө·еӣӣдёӘж°”зҗғпјҢе…¶дёӯжҳҜз”ұCO2еҗ№иө·зҡ„жҳҜпјҲВ В пјү
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D .
е®һйӘҢе®ӨйңҖиҰҒ0.1molLзӣҗй…ёжә¶ж¶І490mLзҺ°иҝӣиЎҢй…ҚеҲ¶пјҢиҜ·з”ЁеәҸеҸ·жҺ’еҮәжӯЈзЎ®зҡ„ж“ҚдҪңйЎәеәҸпјҢ并еңЁжЁӘзәҝдёҠеЎ«еҶҷйҖӮеҪ“зҡ„д»ӘеҷЁеҗҚз§°пјҢж“ҚдҪңж–№жі•жҲ–ж•°еӯ—пјҺ
-
пјҲ1пјү еңЁзӣӣзӣҗй…ёзҡ„зғ§жқҜдёӯжіЁе…Ҙе°‘йҮҸи’ёйҰҸж°ҙпјҢз”ЁзҺ»з’ғжЈ’жҗ…жӢҢпјҢдҪҝе…¶ж··еҢҖпјҺ
еҫ…зЁҖйҮҠзҡ„зӣҗй…ёеҶ·еҚҙеҗҺпјҢжІҝзҺ»з’ғжЈ’жіЁе…Ҙ дёӯпјҺ
-
пјҲ2пјү з”ЁйҮҸзӯ’йҮҸеҸ–еҜҶеәҰдёә1.19g/cm3иҙЁйҮҸеҲҶж•°дёә36.5%зҡ„жө“зӣҗй…ёзәҰ mLжіЁе…Ҙзғ§жқҜдёӯпјҺ
-
пјҲ3пјү з”Ёи’ёйҰҸж°ҙжҙ—ж¶Өзғ§жқҜгҖҒзҺ»з’ғжЈ’2пҪһ3ж¬ЎпјҢе°Ҷжҙ—ж¶Өж¶ІжіЁе…Ҙе®№йҮҸ瓶дёӯ
еҫҖе®№йҮҸ瓶дёӯе°ҸеҝғеҠ и’ёйҰҸж°ҙиҮіж¶ІйқўжҺҘиҝ‘еҲ»еәҰзәҝ cmеӨ„пјҢж”№з”Ё еҠ и’ёйҰҸж°ҙпјҢдҪҝжә¶ж¶І жҒ°еҘҪдёҺеҲ»еәҰзәҝзӣёеҲҮпјҺ
йңҖиҰҒй…ҚеҲ¶2mol/Lзҡ„NaClжә¶ж¶І480mLпјҢй…ҚеҲ¶ж—¶еә”йҖүз”Ёзҡ„е®№йҮҸ瓶зҡ„и§„ж је’Ңз§°еҸ–зҡ„NaClиҙЁйҮҸеҲҶеҲ«жҳҜпјҲгҖҖгҖҖпјү
A . 480mLпјҢ56.2g
B . 500mLпјҢ56.2g
C . 500mLпјҢ58.5g
D . д»»ж„Ҹи§„ж јпјҢ56.2g
дёҺ100mL 0.4molвҖўLп№Ј1NH4NO3жә¶ж¶Ідёӯзҡ„NO3п№Јжө“еәҰзӣёеҗҢзҡ„жҳҜпјҲгҖҖгҖҖпјү
A . 400 mL 0.1 molвҖўLп№Ј1зҡ„KNO3жә¶ж¶І
B . 100 mL 0.4 molвҖўLп№Ј1зҡ„BaпјҲNO3пјү2жә¶ж¶І
C . 100 mL 0.2 molвҖўLп№Ј1зҡ„MgпјҲNO3пјү2жә¶ж¶І
D . 200 mL 0.1molвҖўLп№Ј1зҡ„FeпјҲNO3пјү3жә¶ж¶І
дёӢеҲ—жә¶ж¶ІдёӯпјҢCl-зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰжңҖеӨ§зҡ„жҳҜпјҲ пјү
A . 300 mL0.1 mol/L NaClжә¶ж¶І
B . 10 mL0.2 mol/LAlCl3жә¶ж¶І
C . ж ҮеҮҶзҠ¶еҶөдёӢпјҢ4.48LHClж°”дҪ“й…ҚжҲҗзҡ„1 Lжә¶ж¶І
D . 100 mL0.1 mol/LFeCl3жә¶ж¶І
е·ІзҹҘжҹҗжӨҚзү©иҗҘе…»ж¶Ізҡ„й…Қж–№жҳҜпјҡ0.3molKClгҖҒ0.2molK2SO4гҖҒ0.1molZnSO4е’Ң1LH2OдёӢеҲ—й…Қж–№е’ҢиҜҘиҗҘе…»ж¶ІжүҖеҗ«зҰ»еӯҗжө“еәҰе®Ңе…ЁзӣёеҗҢзҡ„жҳҜ( )(еҒҮи®ҫж¶ІдҪ“дҪ“з§ҜеҸҳеҢ–еҝҪз•ҘдёҚи®Ў)
A . 0.2molKClгҖҒ0.3molK2SO4гҖҒ0.1molZnCl2 е’Ң1LH2O
B . 0.3molKClгҖҒ0.4molK2SO4гҖҒ0.1molZnCl2 е’Ң2LH2O
C . 0.2molKClгҖҒ0.3molK2SO4гҖҒ0.1molZnSO4 е’Ң1LH2O
D . 0.2molKClгҖҒ0.6molK2SO4гҖҒ0.2molZnCl2 е’Ң2LH2O
дёӢеҲ—зӣ®зҡ„иғҪиҫҫеҲ°зҡ„жҳҜпјҲ пјү
A . е°Ҷ58.5gNaClжә¶дәҺ1Lж°ҙдёӯеҸҜеҫ—1molВ·LпјҚ1зҡ„NaClжә¶ж¶І
B . е°Ҷж ҮеҮҶзҠ¶еҶөдёӢ22.4LHClжә¶дәҺ1Lж°ҙдёӯеҸҜеҫ—1molВ·LпјҚ1зӣҗй…ё
C . е°Ҷ25.0gиғҶзҹҫжә¶дәҺж°ҙеҗҺй…ҚжҲҗ100mLжә¶ж¶ІжүҖеҫ—жә¶ж¶Іжө“еәҰдёә1molВ·LпјҚ1
D . е°Ҷ62gNa2Oжә¶дәҺж°ҙпјҢй…ҚжҲҗ1Lжә¶ж¶ІеҸҜеҫ—еҲ°жө“еәҰдёә1molВ·LпјҚ1жә¶ж¶І
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ( )
A . 100 gжә¶иҙЁиҙЁйҮҸеҲҶж•°дёә46%зҡ„д№ҷйҶҮж°ҙжә¶ж¶ІдёӯпјҢеҗ«жңү4NAдёӘж°§еҺҹеӯҗ
B . 1 mol Cl2жә¶дәҺж°ҙпјҢжә¶ж¶ІдёӯCl-гҖҒHClOгҖҒClO-зІ’еӯҗж•°д№Ӣе’Ңе°ҸдәҺ2NA
C . 2.24 L(ж ҮеҮҶзҠ¶еҶө)2H2дёӯеҗ«жңү0.2NAдёӘдёӯеӯҗ
D . 25 в„ғж—¶Ksp(CaSO4)=9Г—10-6 пјҢ еҲҷиҜҘжё©еәҰдёӢCaSO4йҘұе’Ңжә¶ж¶Ідёӯеҗ«жңү3Г—10-3NAдёӘCa2+
16Oе’Ң18OжҳҜж°§е…ғзҙ зҡ„дёӨз§Қж ёзҙ пјҢNAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . 16O2дёҺ18O2дә’дёәеҗҢзҙ ејӮеҪўдҪ“
B . 16OдёҺ18Oж ёеӨ–з”өеӯҗжҺ’еёғж–№ејҸдёҚеҗҢ
C . йҖҡиҝҮеҢ–еӯҰеҸҳеҢ–еҸҜд»Ҙе®һзҺ°16OдёҺ18Oй—ҙзҡ„зӣёдә’иҪ¬еҢ–
D . ж ҮеҮҶзҠ¶еҶөдёӢпјҢ1.12L16O2е’Ң 1.12L18O2еқҮеҗ«жңү0.1NAдёӘж°§еҺҹеӯҗ
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еёёжё©дёӢпјҢ0.5 molВ·LпјҚ1Fe2(SO4)3жә¶ж¶Ідёӯеҗ«Fe3+ж•°зӣ®дёә1 NA
B . 1mol Na2CO3жҷ¶дҪ“дёӯеҗ«CO32- зҰ»еӯҗж•°е°ҸдәҺ1NA
C . еёёжё©еёёеҺӢдёӢпјҢ16g O2е’ҢO3ж··еҗҲж°”дҪ“дёӯпјҢеҗ«ж°§еҺҹеӯҗзҡ„жҖ»ж•°дёә1NA
D . 5.6g FeдёҺи¶ійҮҸзЁҖзӣҗй…ёеҸҚеә”пјҢиҪ¬з§»з”өеӯҗж•°дёә0.3NA
е·ІзҹҘNAжҳҜйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )
A . 1L 0.1mol/L зЁҖзӣҗй…ёдёӯеҗ«HClеҲҶеӯҗзҡ„ж•°зӣ®дёә0.1NA
B . 0.1mol/LзЈ·й…ёй’ жә¶ж¶ІдёӯPO43-ж•°зӣ®е°ҸдәҺ0.1NA
C . 25в„ғпјҢ1L pHпјқ1зҡ„H3PO4жә¶ж¶ІдёӯпјҢж°ҙз”өзҰ»дә§з”ҹзҡ„OH- ж•°зӣ®дёә10-13 NA
D . 0.1 L 0.5 mol/L CH3COOHжә¶ж¶Ідёӯеҗ«жңүзҡ„H+ж•°дёә0.05NA
и®ҫ NA дёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•дёӯжӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . ж ҮеҮҶзҠ¶еҶөдёӢпјҢ11.2L H2 дёҺ 11.2L D2 жүҖеҗ«зҡ„иҙЁеӯҗж•°еқҮдёәNA
B . 1L0.1molВ·L-1Fe2пјҲSO4пјү3 жә¶ж¶Ідёӯеҗ« Fe3+ж•°зӣ®дёә 0.2 NA
C . 3.2g й“ңдёҺ 3.2g зЎ«йҡ”з»қз©әж°”еҠ зғӯдҪҝд№Ӣе……еҲҶеҸҚеә”пјҢиҪ¬з§»з”өеӯҗж•°дёә 0.1 NA
D . 0.1mol д№ҷйҶҮдёҺ 0.1mol д№ҷй…ёеңЁдёҖе®ҡжқЎд»¶дёӢеҸҚеә”з”ҹжҲҗд№ҷй…ёд№ҷй…ҜеҲҶеӯҗж•°дёә 0.1 NA
NAд»ЈиЎЁйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢ еҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ( )
A . 18 g зҡ„D2Oдёӯеҗ«жңүзҡ„иҙЁеӯҗж•°дёә10 NA
B . 12 g йҮ‘еҲҡзҹідёӯеҗ«жңүеҢ–еӯҰй”®зҡ„ж•°зӣ®дёә4NA
C . 28 g зҡ„д№ҷзғҜе’ҢзҺҜе·ұзғ·ж··еҗҲж°”дҪ“дёӯжүҖеҗ«еҺҹеӯҗжҖ»ж•°дёә6 NA
D . 1 L1 mol/Lзҡ„NH4CIжә¶ж¶ІдёӯNH4+е’ҢCl-зҡ„ж•°зӣ®еқҮдёәNA
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . й…ёзўұдёӯе’ҢеҸҚеә”йғҪеҸҜд»Ҙз”ЁH++OHЛү=H2OиЎЁзӨә
B . з©әж°”дёӯж•һеҸЈд№…зҪ®зҡ„жө“зЎ«й…ёиҙЁйҮҸеўһеӨ§жҳҜеӣ дёәжө“зЎ«й…ёе…·жңүжҢҘеҸ‘жҖ§
C . й…ҚеҲ¶жә¶ж¶Іе®ҡе®№ж—¶пјҢдҝҜи§Ҷе®№йҮҸ瓶еҲ»еәҰзәҝдјҡдҪҝжә¶ж¶Іжө“еәҰеҒҸй«ҳ
D . з”Ёи’ёйҰҸж°ҙж¶Ұж№ҝзҡ„pHиҜ•зәёжөӢжә¶ж¶Ізҡ„pHпјҢдёҖе®ҡдјҡдҪҝз»“жһңеҒҸдҪҺ
жңүBaCl2е’ҢKClзҡ„ж··еҗҲжә¶ж¶ІaLпјҢе°Ҷе®ғеҲҶжҲҗдёӨзӯүд»ҪпјҢе…¶дёӯдёҖд»Ҫж»ҙеҠ зЁҖзЎ«й…ёпјҢдҪҝBa2+зҰ»еӯҗе®Ңе…ЁжІүж·ҖпјӣеҸҰдёҖд»Ҫж»ҙеҠ AgNO3жә¶ж¶ІпјҢдҪҝCl-зҰ»еӯҗе®Ңе…ЁжІүж·ҖгҖӮеҸҚеә”дёӯж¶ҲиҖ—xmolH2SO4гҖҒymolAgNO3 пјҢ жҚ®жӯӨеҸҜзҹҘеҺҹж··еҗҲжә¶ж¶Ідёӯзҡ„K+зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәпјҲ пјү
A .  molВ·L-1
B .
molВ·L-1
B . 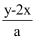 molВ·L-1
C .
molВ·L-1
C . 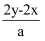 molВ·L-1
D .
molВ·L-1
D . 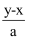 molВ·L-1
molВ·L-1
 molВ·L-1
B .
molВ·L-1
B . 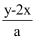 molВ·L-1
C .
molВ·L-1
C . 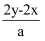 molВ·L-1
D .
molВ·L-1
D . 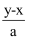 molВ·L-1
molВ·L-1
 иЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
иЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . 18g дёӯеҗ«жңүзҡ„иҙЁеӯҗж•°дёә10
дёӯеҗ«жңүзҡ„иҙЁеӯҗж•°дёә10 B . 48g
B . 48g е’Ң
е’Ң зҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°зӣ®дёә3
зҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°зӣ®дёә3 C . 16.25g
C . 16.25g ж°ҙи§ЈеҪўжҲҗзҡ„
ж°ҙи§ЈеҪўжҲҗзҡ„ иғ¶дҪ“зІ’еӯҗж•°зӣ®дёә0.1
иғ¶дҪ“зІ’еӯҗж•°зӣ®дёә0.1 D . 25в„ғж—¶пјҢ
D . 25в„ғж—¶пјҢ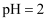 зҡ„зӣҗй…ёдёӯеҗ«жңүзҡ„
зҡ„зӣҗй…ёдёӯеҗ«жңүзҡ„ ж•°зӣ®дёә0.01
ж•°зӣ®дёә0.01
 дёӯеҗ«жңүзҡ„иҙЁеӯҗж•°дёә10
дёӯеҗ«жңүзҡ„иҙЁеӯҗж•°дёә10 B . 48g
B . 48g е’Ң
е’Ң зҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°зӣ®дёә3
зҡ„ж··еҗҲж°”дҪ“дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°зӣ®дёә3 C . 16.25g
C . 16.25g ж°ҙи§ЈеҪўжҲҗзҡ„
ж°ҙи§ЈеҪўжҲҗзҡ„ иғ¶дҪ“зІ’еӯҗж•°зӣ®дёә0.1
иғ¶дҪ“зІ’еӯҗж•°зӣ®дёә0.1 D . 25в„ғж—¶пјҢ
D . 25в„ғж—¶пјҢ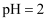 зҡ„зӣҗй…ёдёӯеҗ«жңүзҡ„
зҡ„зӣҗй…ёдёӯеҗ«жңүзҡ„ ж•°зӣ®дёә0.01
ж•°зӣ®дёә0.01
NAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . 1.0molCH4дёҺCl2еңЁе…үз…§дёӢеҸҚеә”з”ҹжҲҗзҡ„CH3ClеҲҶеӯҗж•°дёәNA
B . 0.1mol/Lзҡ„Na2CO3жә¶ж¶ІдёӯйҳізҰ»еӯҗж•°зӣ®дёә0.2NA
C . 12gйҮ‘еҲҡзҹідёӯеҗ«жңүеҢ–еӯҰй”®зҡ„ж•°зӣ®дёә2NA
D . еҗ«0.2molH2SO4зҡ„жө“зЎ«й…ёе’Ңи¶ійҮҸзҡ„й“ңеҸҚеә”пјҢиҪ¬з§»з”өеӯҗж•°дёә0.2NA
е°Ҷ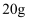 еҗ«жқӮиҙЁ
еҗ«жқӮиҙЁ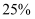 зҡ„еӨ§зҗҶзҹі(жқӮиҙЁдёҺзӣҗй…ёдёҚеҸҚеә”)жҠ•е…Ҙ
зҡ„еӨ§зҗҶзҹі(жқӮиҙЁдёҺзӣҗй…ёдёҚеҸҚеә”)жҠ•е…Ҙ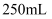 зӣҗй…ёдёӯжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢи®Ўз®—пјҡ(еҶҷеҮәи®Ўз®—иҝҮзЁӢ)
зӣҗй…ёдёӯжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢи®Ўз®—пјҡ(еҶҷеҮәи®Ўз®—иҝҮзЁӢ)
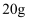 еҗ«жқӮиҙЁ
еҗ«жқӮиҙЁ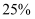 зҡ„еӨ§зҗҶзҹі(жқӮиҙЁдёҺзӣҗй…ёдёҚеҸҚеә”)жҠ•е…Ҙ
зҡ„еӨ§зҗҶзҹі(жқӮиҙЁдёҺзӣҗй…ёдёҚеҸҚеә”)жҠ•е…Ҙ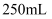 зӣҗй…ёдёӯжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢи®Ўз®—пјҡ(еҶҷеҮәи®Ўз®—иҝҮзЁӢ)
зӣҗй…ёдёӯжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢи®Ўз®—пјҡ(еҶҷеҮәи®Ўз®—иҝҮзЁӢ)
-
пјҲ1пјү еҸҚеә”з”ҹжҲҗзҡ„
 зҡ„дҪ“з§Ҝ(ж ҮеҮҶзҠ¶еҶө)
зҡ„дҪ“з§Ҝ(ж ҮеҮҶзҠ¶еҶө)
-
пјҲ2пјү еҺҹзӣҗй…ёзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰгҖӮ
жңҖиҝ‘жӣҙж–°



