第二节 元素周期律 知识点题库
下列叙述正确的是( )
A . NH3、CO、CO2都是极性分子
B . 10Be、9Be、8Be是摩尔质量不同的三种同素异形体
C . HF、HCl、HBr、HI的稳定性依次增强
D . HF、HCl、HBr、HI的酸性依次增强
对于周期表中下列位置的①~⑩十种元素,根据有关要求回答:

-
(1) 能形成共价键的元素共有种。
-
(2) 只需形成一个共价单键就能达到稳定结构的元素有(填元素符号)。
-
(3) 气态氢化物溶于水生成的呈碱性的化合物是(填化学式)。
-
(4) ⑩号元素最高正价含氧酸只含有键。
-
(5) ①⑤⑦形成的化合物的电子式为。
-
(6) 某元素的气态氢化物为H2B,其最高价氧化物中B的质量分数为40%,则其气态氢化物的电子式为,它与③的化合物的分子式为,含有的化学键类型有。
某元素位于周期表中第四周期第ⅤA族,则该元素的名称和价电子层均正确的是( )
A . 砷 4s24p3
B . 溴 4s24p5
C . 磷 4s24p3
D . 锑 5s25p3
常温下,A是只含X和Y两种短周期元素的气体,X的原子序数小于Y,甲、乙、丙分别是X、Y、Z元素的单质,Z是地壳中含量最高的元素。甲、乙、丙和B、C、D都是常见的物质,其转化关系如图所示。下列说法正确的是( )

A . 原子半径:Z>X>Y
B . 常温常压下,Z的氢化物为气态
C . 反应②为化合反应,反应③为置换反应
D . 由X、Y、Z三种元素组成的化合物可能是离子化合物
短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是( )
A . 原子半径:r(X) <r(Y) <r(Z) <r(W)
B . X、Y、Z三种元素可以组成共价化合物和离子化合物
C . Y的单质的氧化性比Z的强
D . W的最高价氧化物的水化物是一种弱碱
短周期元素X、Y、Z、W原子序数依次增大且原子最外层电子数为互不相等的奇数:X与Y位于不同周期;X与W的最高化合价之和为8;Z的单质既能和强酸反应又能和强碱反应。则下列说法错误的是( )
A . 原子半径:Z>W>Y>X
B . YX4W中含有离子键和共价键
C . Y、Z形成的一种化合物强度高,热膨胀系数小,是良好的耐火材料
D . 工业上常用电解ZW3的方法制取单质Z
下表是部分短周期元素的原子半径及主要化合价,根据表中信息,判断下列叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.037 | 0.143 | 0.186 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +1 | +6、-2 | -2 |
A . Q+与T2-的核外电子数相等
B . L与T形成的化合物不可能含非极性键
C . 最高价氧化物对应水化物的碱性:Q<M
D . R2-的还原性小于T2-的还原性
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
A . Y元素最高价氧化物对应的水化物化学式出H2YO4
B . 原子半径由小到大的顺序为:X<Z<Y
C . Y、Z两种元素的气态氢化物中,Z的气态氢化物最稳定
D . X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
超重元素的假说预言自然界中可以存在原子序数为114 号的稳定同位素  ,请根据原子结构理论和元素周期律预测:
,请根据原子结构理论和元素周期律预测:
 ,请根据原子结构理论和元素周期律预测:
,请根据原子结构理论和元素周期律预测:
-
(1) 该元素位于元素周期表第周期,第族。
-
(2) 写出最高价氧化物为其对应水化物的化学式,并估计后者为性(酸、碱性)。
下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
|
族 周期 |
IA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
二 |
① |
② |
③ |
④ |
||||
|
三 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
-
(1) 非金属性最强的元素是(填元素符号,下同),形成化合物种类最多的元素是。
-
(2) ③④⑤⑥元素的离子半径从大到小顺序是(填离子符号),表中十种元素最高价氧化物对应水化物中具有两性的是(填写化学式)。
-
(3) ⑤⑥⑦单质的活泼性顺序为 (从大到小排列,填元素符号),判断的实验依据是(写出一种)。
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题。
|
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
|
2 |
C |
N |
O |
F |
Ne |
|||
|
3 |
Na |
Al |
P |
S |
Cl |
-
(1) 单质的化学性质最不活沷的元素是;
-
(2) 氧的原子结构示意图是;
-
(3) 形成化合物种类最多的元素是;
-
(4) HF和H2O中,热稳定性较强的是;
-
(5) N和P中,原子半径较小的是;
-
(6) 常温下,会在浓硫酸中发生钝化的金属是;
-
(7) 元素最高价氧化物对应水化物中,碱性最强的是(填化学式),酸性最强的是(填“H2SO4”或“ HClO4”);
X、Y、Z、W是原子序数依次增大的短周期主族元素,X的单质是密度最小的金属,Y原子的最外层电子数是其内层电子数的3倍,Y、Z同主族。下列叙述正确的是( )
A . X的单质通常保存在煤油中
B . 简单氢化物的稳定性:Y<Z<W
C . Z的氧化物对应的水化物均为强酸
D . Z2W2中各原子最外层均满足8电子稳定结构
部分短周期元素的原子半径与元素的最高价及最低价的关系如图所示。

请填写下列空白:
-
(1) 图中涉及种元素,其中元素 (用化学用语表示,下同 )的金属性最强。
-
(2) 元素①的最简单氢化物的电子式为;元素②的原子结构示意图为。
-
(3) 元素③和⑨对应的单质加热条件下反应的方程式为。
-
(4) 元素④在周期表中的位置是;元素⑤、⑥对应的最高价氧化物的水化物酸性强弱关系为;元素⑦和元素⑧两者核电荷数之差是。
一种矿石  的组成元素W、X、Y、Z为原子序数依次增大的短周期元素,Z单质燃烧发出耀眼的白光,X原子L层比K层多一个电子,
的组成元素W、X、Y、Z为原子序数依次增大的短周期元素,Z单质燃烧发出耀眼的白光,X原子L层比K层多一个电子,  分子中含有10个电子。下列说法正确的是( )
分子中含有10个电子。下列说法正确的是( )
 的组成元素W、X、Y、Z为原子序数依次增大的短周期元素,Z单质燃烧发出耀眼的白光,X原子L层比K层多一个电子,
的组成元素W、X、Y、Z为原子序数依次增大的短周期元素,Z单质燃烧发出耀眼的白光,X原子L层比K层多一个电子,  分子中含有10个电子。下列说法正确的是( )
分子中含有10个电子。下列说法正确的是( )
A . 原子半径: 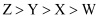 B . 常温常压下单质沸点:
B . 常温常压下单质沸点: 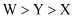 C . Z与Y可形成共价化合物ZY
D . X的最高价氧化物的水化物是弱酸
C . Z与Y可形成共价化合物ZY
D . X的最高价氧化物的水化物是弱酸
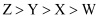 B . 常温常压下单质沸点:
B . 常温常压下单质沸点: 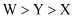 C . Z与Y可形成共价化合物ZY
D . X的最高价氧化物的水化物是弱酸
C . Z与Y可形成共价化合物ZY
D . X的最高价氧化物的水化物是弱酸
图为元素周期表短周期的一部分,其中X元素原子最外层电子数是次外层的两倍。下列说法错误的是( )
| X | Y | ||
| Z | W |
A . X的原子半径比Y的大
B . Y元素的非金属性比Z强
C . z元素位于第3周期ⅣA族
D . W的氧化物的水化物是强酸
部分短周期元素原子半径与原子序数的关系如图所示,下列说法错误的是( )

A . 最高价氧化物对应水化物的碱性:M<Z
B . 组成单质的熔点:Z<M<N
C . Y、R两种元素气态氢化物的还原性:Y>R
D . 简单离子的半径:R>M>Y
我国科学家潘锦功发明了“碲化镉薄膜太阳能电池”,被科学家称为“挂在墙壁上的油田”。下列说法错误的是( )

A . 周期表中碲和镉都位于长周期
B . 该电池将光能全部转化成电能
C . 推广使用该电池有利于“碳中和”
D . 保护层压件的铝合金属于金属材料
X、Y、Z、W是四种原子序数依次增大的短周期主族元素,其中X、W同主族,Y、Z同周期且与其他两种元素均不在同一周期,Y与Z的原子序数之和为14,Z形成的某种单质是空气的主要成分之一、下列叙述中错误的是( )
A . 原子半径:W>Y>Z>X
B . Z的最高正化合价与最低负化合价代数和为4
C . 非金属性:Y<Z
D . Z与W形成的化合物中可能既含离子键,又含共价键
短周期元素X、Y,Z、W的原子序数依次增大。用表中信息判断下列说法正确的是( )
|
元素最高价氧化物的水化物 |
X |
Y |
Z |
W |
|
分子式 |
H3ZO4 |
|||
|
0.1mol•L-1溶液对应的pH(25℃) |
1.00 |
13.00 |
1.57 |
0.70 |
A . 元素电负性:W<Z
B . 简单离子半径:X<Y
C . 元素第一电离能:W<Z
D . 简单气态氢化物的稳定性:X<Z
X、Y、Z、M、Q为五种短周期元素,其原子半径与最外层电子数之间的关系如图所示。下列说法错误的是( )

A . Q与氧元素形成的化合物不含共价键
B . Z与X能形成不只一种含10个电子的微粒
C . M的氢化物能与M的低价氧化物发生反应
D . Y元素存在多种同素异形体
最近更新



