第二节 元素周期律 知识点题库
依据元素周期表及元素周期律,下列推断正确的是( )
A . 同一周期元素的原子,半径越小越容易失去电子
B . ⅠA族元素的金属性比ⅡA族元素的金属性强
C . 若M+和R2﹣的核外电子层结构相同,则原子序数:R>M
D . 主族元素的最高正化合价等于该元素原子的最外层电子数
几种短周期元素的原子半径及化合价见表:
元素代号 | A | B | D | E | G | H | I | J |
化合价 | ﹣1 | ﹣2 | +4、﹣4 | +6、﹣2 | +5、﹣3 | +3 | +2 | +1 |
原子半径/nm | 0.071 | 0.074 | 0.130 | 0.102 | 0.110 | 0.143 | 0.160 | 0.186 |
分析上表中有关数据,结合已学过的知识,回答以下问题.涉及上述元素的答案,请用元素符号表示.
-
(1) E元素在周期表中的位置是.
-
(2) A,H,J对应的离子半径由大到小的顺序是(填写离子符号).
-
(3) 用电子式表示A与I所形成化合物的形成过程.
-
(4) B与H所形成的化合物与J的最高价氧化物的水化物X的溶液发生反应的离子方程式为;
-
(5) 用B与D所形成的化合物制备D单质的化学方程式为.
下列比较正确的是( )
A . 稳定性:SiH4>PH3
B . 碱性:Mg(OH)2>Al(OH)3
C . 酸性:H3PO4>H2SO4
D . 原子半径:N>C
同周期的 IIA 族元素与IIIA族元素核电荷数相差不可能是( )
A . 1
B . 11
C . 17
D . 25
下列说法正确的是( )
A . 元素周期表中短周期都是主族元素
B . 原子核外在离核较远区域的电子易失去,其原因是这些电子的能量较高
C . 通过化学变化可以实现16O与18O间的相互转化
D . 对于吸收能量的反应必需加热才能发生
钫(Fr)元素在周期表中位于第七周期,第IA族,根据钫在周期表中的位置推测其性质,其中错误的是
( )
A . 其单质的熔点比钠的熔点低
B . 在空气中燃烧只能生成Fr2O
C . 其原子半径在同一主族中是最大的
D . 氧化物对应的水化物的碱性很强
硒(34Se)元素是人体必需的微量元素,它在自然界有六种核素.下列有关78Se和80Se的说法不正确的是( )
A . 两者的质量数不同
B . 两者的中子数不同
C . 两者的核外电子数相同
D . 两者互为同素异形体
下列表达正确的是( )
A . 氧族元素包括氧、硫、锡、碲、钋
B . Na2O2固体中的阳离子和阴离子个数比为1:1
C . H,D,T,H+可以用来表示氢元素的四种同位素
D . 表示金属元素名称的汉字不一定都含“钅”旁
现有五种元素,其中A、B、C为短周期主族元素,D、E为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
|
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
|
B元素原子的核外p电子数比s电子数少1 |
|
C原子的第一至第四电离能分别是:I1=738 kJ·mol-1 , I2=1 451 kJ·mol-1 , I3=7 733 kJ·mol-1 , I4=10 540 kJ·mol-1 |
|
D是前四周期中电负性最小的元素 |
|
E在周期表的第七列 |
-
(1) 已知BA5为离子化合物,写出其电子式。
-
(2) 比较BA2-和BA3的键角∠ABA的大小:BA2-(填“>”“=”或“<”)BA3 , 请用价层电子对互斥理论解释:。
-
(3) 某同学根据上述信息,推断C基态原子的核外电子排布图为
 ,该同学所画的电子排布图违背了。
,该同学所画的电子排布图违背了。
-
(4) E位于族区,价电子排布式为。
-
(5) 检验D元素的方法是,请用原子结构的知识解释产生此现象的原因是
五种短周期元素X、Y、Z、M、W的原子序数与其某常见化合价的关系如右图所示,下列关系错误的是( )

A . 元素X可能为锂
B . 原子半径大小:r(M)>r(w)
C . X2W中各原子均达8电子稳定结构
D . 元素气态氢化物的稳定性:YH3>MH3
下列根据元素周期律得出的结论正确的是( )
A . NaOH、Mg (OH)2、Al (OH) 3 的碱性依次增强
B . HCl、HBr、HI 的稳定性依次增强
C . Na+、Mg2+、Al3+的半径依次增大
D . P、S, Cl 的最高化合价依次升高
下列表达方式不正确的是( )
A . 碱性NaOH>Mg(OH)2>Al(OH)3
B . 氟化钠的电子式  C . 酸性HClO>H2SO4
D . 碳-12原子126C
C . 酸性HClO>H2SO4
D . 碳-12原子126C
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z是同周期中原子半径最大的元素,W的最高正价为+7价.下列说法正确的是( )
A . 简单离子半径大小顺序:rW>rZ>rY
B . 元素W的氧化物对应水化物的酸性比Y的强
C . X与Y形成的原子晶体X3Y4的熔点可能比金刚石高
D . X与W形成的化合物和Z与W形成的化合物的化学键类型相同
W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是( )
A . 非金属性:W> X>Y> Z
B . 原子半径:Z>Y>X>W
C . 元素X的含氧酸均为强酸
D . Y的氧化物水化物为强碱
117号元素Ts的原子最外层电子数是7,下列说法错误的是( )
A . Ts是第七周期第ⅦA族元素
B . 还原性:I−<Ts−
C . 原子半径:I<Ts
D . 中子数为176的Ts的核素符号: 

A、B、C均为短周期元素,它们在周期表中的位置如图所示.已知B、C元素的族序数之和是A元素族序数的2倍,B和C元的原子序数之和是A的4倍,则A、B、C分别为( )

A . 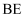 、
、 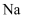 、
、 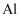 B .
B .  、
、 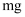 、
、  C .
C .  、
、 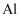 、
、 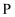 D .
D .  、
、 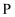 、
、 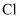
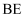 、
、 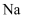 、
、 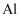 B .
B .  、
、 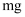 、
、  C .
C .  、
、 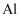 、
、 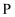 D .
D .  、
、 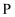 、
、 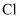
部分元素的性质与原子结构如下表:
|
元素编号 |
元素性质与原子(或分子)结构 |
|
W |
最外层电子数是次外层电子数的3倍 |
|
X |
位于第二周期,最高正价与最低负价代数和为2 |
|
Y |
第三周期主族元素中原子中半径最大 |
|
Z |
第三周期元素简单离子中半径最小 |
-
(1) 画出W的简单离子结构示意图。
-
(2) 元素W与X相比,得电子能力较强的是(用元素符号表示),从原子结构角度解释原因是。
-
(3) 元素W与元素Y能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式。
-
(4) Z的最高价氧化物对应的水化物既能与酸反应,又能与碱反应,用离子方程式表示出该物质分别与强酸、强碱的反应、。
已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中Y的最高化合价为+3。下列说法不正确的是( )

A . 还原性:  B . X能从
B . X能从  中置换出Z
C . Y能与
中置换出Z
C . Y能与  反应得到Fe
D . M最高价氧化物的水化物能与其最低价氢化物反应
反应得到Fe
D . M最高价氧化物的水化物能与其最低价氢化物反应
 B . X能从
B . X能从  中置换出Z
C . Y能与
中置换出Z
C . Y能与  反应得到Fe
D . M最高价氧化物的水化物能与其最低价氢化物反应
反应得到Fe
D . M最高价氧化物的水化物能与其最低价氢化物反应
某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍;W的最高价氧化物对应的水化物具有两性,W、X、Y三种简单离子的核外电子排布相同。下列说法正确的是( )
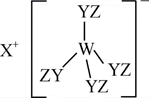
A . X与Y、Y与Z均可形成X2Y、Z2Y2型化合物
B . 离子半径:X>W>Y>Z
C . X、Y、Z组成的化合物中只含有离子键
D . 常温常压下熔点:X2Y<Z2Y
由下列实验操作和现象所得结论均正确的是( )
选项 | 实验操作和现象 | 实验结论 |
A | 将亚硫酸钠样品溶于水,加入盐酸酸化的Ba(NO3)2溶液有白色沉淀产生 | 样品已变质 |
B | 将盐酸滴入NaHCO3溶液,产生的无色无味气体能使澄清石灰水变浑浊 | 非金属性:Cl>C |
C | 铁投入冷的浓硝酸中无明显现象,投入稀硝酸中有气泡冒出 | 氧化性:稀硝酸>浓硝酸 |
D | 向Na2SO3溶液中滴入稀盐酸,产生刺激性气味的气体可使品红溶液褪色 | 酸性:HCl>H2SO3 |
A . A
B . B
C . C
D . D
最近更新



