第二节 元素周期律 知识点题库
下列说法正确的是( )
A . I的原子半径大于Br,HI比HBr的热稳定性强
B . P的非金属性强于Si,H3PO4比H2SiO3的酸性强
C . Al2O3和MgO均可与NaOH溶液反应
D . SO2和SO3混合气体通入Ba(NO3)2溶液可得到BaSO3和BaSO4
比较钠、铝、氮的离子半径大小,并说明原因.
如图所示,在元素周期表中处于A,B位置的某些元素性质相似,这称为“对角线规则”.下列有关4号元素铍的性质的推断正确的是( )
A | |
B |
A . 铍能与冷水发生剧烈反应
B . 氢氧化铍既能与强酸溶液反应,又能与强碱溶液反应
C . 氢氧化铍的化学式为Be(OH)3
D . 氧化铍只溶于强酸溶液,不溶于强碱溶液
下表为元素周期表的一部分,请回答有关问题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
-
(1) ⑤和⑧的元素符号是和.
-
(2) 表中最活泼的金属元素是,形成化合物种类最多的元素是(填写元素名称).
-
(3) 表中能形成两性氢氧化物的元素是,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:;.
-
(4) 证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:.
下列各组元素中,电负性依次减小的是( )
A . K,Na,Al
B . F,Cl,H
C . As,P,H
D . O,S,Cl
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
①X元素的原子有二个电子层,处于周期表的第15个纵行 ②Z的原子序数为31,单质常温下为液体 ③气态氢化物水溶液的酸性X<Y<Z ④X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 ⑤Z的原子序数比Y大19,Y的原子序数比X大9.
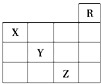
A . 只有②
B . 只有①③④⑤
C . 只有①②③④
D . 全部
已知原子序数为a的元素M位于第6周期第ⅡA族,元素N为同周期的第ⅢA族,则N的原子序数为.
下列各组微粒,没有按照半径由小到大顺序排列的是( )
A . Cl、Na、F、K
B . F、Cl、Na、K
C . Ca2+、K+、Cl-、S2-
D . Na+、K+、Cl-、Br-
已知第三周期元素M,其原子最外层达到饱和时所需的电子数小于次外层与最内层电子数之差,且等于最内层电子数的正整数倍。下列关于元素M的说法一定错误的是( )
A . M元素存在同素异形体
B . M元素为非金属元素
C . M的最高价氧化物对应的水化物都是强酸
D . 常温下,能稳定存在的M的氧化物都是酸性氧化物
如图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是( )

A . y轴表示的可能是第一电离能
B . y轴表示的可能是电负性
C . y轴表示的可能是原子半径
D . y轴表示的可能是形成基态离子转移的电子数
绘制了第一张元素周期表的科学家是( )
A . 戴维
B . 侯德榜
C . 门捷列夫
D . 道尔顿
X、Y、Z、W均为短周期元素,它们在元素周期表中位置如图所示,已知W原子的最外层电子数比内层电子数少3个,下列说法正确的是( )

A . W的氧化物对应的水化物是强酸
B . 原子半径:X﹥Y
C . Z单质氧化性强于Y单质
D . X的氢化物的水溶液呈酸性
短周期部分元素原子半径与原子序数的关系如图,下列说法正确的是( )

A . 相同条件下,Y的氢化物比X的氢化物更稳定,熔沸点也更高
B . A单质通常保存在煤油中
C . Y的单质能从含R简单离子的水溶液中置换出R单质
D . M的最高价氧化物对应水化物能分别与Z、R的最高价氧化物对应水化物反应
A、B为短周期元素,二者可以组合成多种中学生所熟知的化合物。在这些化合物中,A与B的原子个数比为A:B=1:2。已知A的原子序数为n,B的原子序数是①n+2;②n+3;③n+4;④n+5;⑤n+8;⑥n-5;⑦n-7;⑧n-8中的几种,其中不符合题目要求的是( )
A . ①④
B . ②⑧
C . ③⑤
D . ⑥⑦
短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
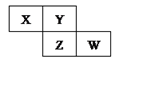
A . 原子半径:W>Z>Y>X
B . 最高价氧化物对应水化物的酸性:Z>W>X
C . 与H2化合,Z比W更容易
D . 形成的气态氢化物溶于水,溶液呈碱性的是X
下列元素中,不属于第ⅠA族的是( )
A . 锂
B . 钠
C . 镁
D . 钾
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | G | L | M | Q | R | T |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.104 | 0.075 | 0.066 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +5、-3 | -2 |
A . 氢氧化物碱性:G<L<M
B . 非金属性:T<Q
C . L2+与T2-的核外电子数相等
D . 气态氢化物的稳定性:R>T
现有A、B、C、D、E、F六种短周期元素,其相关性质信息如下。请回答下列问题:
|
元素 |
特征 |
元素 |
特征 |
|
A |
常见金属,其最高价氧化物对应的水化物可以溶于强碱 |
D |
在地壳中含量最多 |
|
B |
常见化肥的主要元素,单质常温下呈气态 |
E |
单质为黄绿色有毒气体 |
|
C |
在短周期主族元素中,原子半径最大 |
F |
原子的核外电子只有1个 |
-
(1) 元素D在元素周期表中的位置为,其原子的结构示意图为。
-
(2) A,C,D对应的简单离子的半径由大到小的排序是(用离子符号表示)。
-
(3) B的最简单氢化物的稳定性(填“>”、“<”或“=”)
 的稳定性。
的稳定性。
-
(4)
 溶液中存在的化学键类型有(填“离子键”、“共价键”或“离子键和共价键”)。A的最高价氧化物的水化物与
溶液中存在的化学键类型有(填“离子键”、“共价键”或“离子键和共价键”)。A的最高价氧化物的水化物与  溶液反应的离子方程式为。
溶液反应的离子方程式为。
-
(5) 用电子式表示化合物
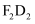 的形成过程。
的形成过程。
-
(6) 已知
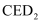 是一种强氧化性漂白剂,它在碱性环境中稳定存在。在碱性条件下,
是一种强氧化性漂白剂,它在碱性环境中稳定存在。在碱性条件下,  和
和  恰好完全反应,该反应的离子方程式为。
恰好完全反应,该反应的离子方程式为。
下表是元素周期表的一部分,其中X、Y、Z、W均为短周期主族元素,已知Z的最外层电子数是其电子层数的3倍,下列说法不正确的是( )
X | Y | Z | |
W |
A . 简单离子半径: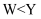 B . 仅由X与Z形成的化合物中只存在共价键
C . 最简单氢化物的沸点:
B . 仅由X与Z形成的化合物中只存在共价键
C . 最简单氢化物的沸点: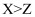 D . 最高价氧化物对应水化物的酸性:
D . 最高价氧化物对应水化物的酸性: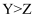
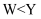 B . 仅由X与Z形成的化合物中只存在共价键
C . 最简单氢化物的沸点:
B . 仅由X与Z形成的化合物中只存在共价键
C . 最简单氢化物的沸点: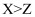 D . 最高价氧化物对应水化物的酸性:
D . 最高价氧化物对应水化物的酸性: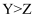
X、Y、Z、W是原子序数依次增大的四种短周期元素,Y元素的某种单质在自然界中硬度最大,Z是地壳中含量最高的元素,四种元素原子最外层电子数之和为12。A、B、C、D、E是由其中的2种或3种元素组成的化合物,F是由Z元素形成的单质。已知: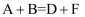 ,
, 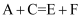 。常温下,
。常温下,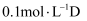 溶液的pH为13。下列说法正确的是( )
溶液的pH为13。下列说法正确的是( )
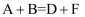 ,
, 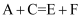 。常温下,
。常温下,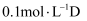 溶液的pH为13。下列说法正确的是( )
溶液的pH为13。下列说法正确的是( )
A . 原子半径:W>Z>Y>X
B . 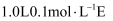 溶液与
溶液与 盐酸充分反应后,溶液显酸性
C .
D . E中所含的化学键类型不同D.用上述两个反应制备等量的F,转移电子数相等
盐酸充分反应后,溶液显酸性
C .
D . E中所含的化学键类型不同D.用上述两个反应制备等量的F,转移电子数相等
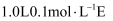 溶液与
溶液与 盐酸充分反应后,溶液显酸性
C .
D . E中所含的化学键类型不同D.用上述两个反应制备等量的F,转移电子数相等
盐酸充分反应后,溶液显酸性
C .
D . E中所含的化学键类型不同D.用上述两个反应制备等量的F,转移电子数相等
最近更新



