第二节 元素周期律 知识点题库
下列有关性质的比较,不正确的是( )
A . 酸性强弱:HI>HBr>HCl
B . 非金属性:O>S>Se
C . 还原性强弱:F->Cl->I-
D . 碱性强弱:KOH>NaOH>LiOH
已知X、M都是中学教材常见元素,下列对两个离子反应通式的推断中,其中正确的是( )
(甲) XO3n﹣+Xn﹣+H+→X单质+H2O(未配平); (乙)Mm++mOH﹣=M(OH)m↓
①若n=1,则XO3n﹣中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m .
A . ①③
B . ②③
C . ①②
D . ④⑤
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于短周期.A是原子半径最小的元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数是未成对电子数的3倍;E有“生物金属”之称,E4+和氩原子的核外电子排布相同.A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂.
请回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示):
-
(1) A2D2分子的电子式为,E的基态原子的外围电子排布式为.
-
(2) B、C、D三种元素的第一电离能由小到大的顺序为.
-
(3) 单质B与C的最高价氧化物的水化物的浓溶液微热反应,其化学方程式为
-
(4) 下列叙述正确的是(填序号).
a.M是极性分子,N是非极性分子 b. M和BD2分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和1个π键 d.BD2晶体的熔点、沸点都比二氧化硅晶体的低
-
(5) 已知:①E的一种氧化物Q,其晶胞结构如图所示

①Q(s)+2Cl2(g)=ECl4(l)+D2(g)△H=+140kJ/mol
②2B(s)+D2(g)=2BD(g)△H=﹣221kJ/mol
写出物质Q和焦炭、氯气反应生成液态ECI4和BD气体的热化学方程式:.
表是元素周期表的一部分,回答下列有关问题:
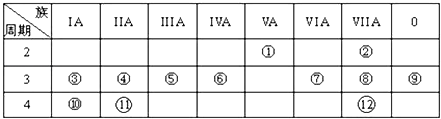
-
(1) 画出⑥的原子结构示意图:,写出①的气态氢化物分子的电子式.
-
(2) 元素④、⑩、⑪的最高价氧化物水化物的碱性最强的为;元素②、⑦、⑧的氢化物稳定性由强到弱的顺序为(均用化学式填空).
-
(3) ③与氧形成的化合物R2O2中所含化学键类型为.
-
(4) 与①和⑥都相邻的一种元素A,它有多种不同形态的单质,其中一种常用作原电池的电极,有一新型燃料电池,是用两根金属做电极插入KOH溶液中,然后向X极通入A的最简单气态氢化物,向Y极通入O2 , 请写出电极反应式:
负极 正极.
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法正确的是( )
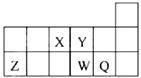
A . 元素X与元素Z的最高正化合价之和的数值等于8
B . 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C . 离子Y2﹣和Z3+的核外电子数和电子层数都不相同
D . 元素W的最高价氧化物对应的水化物的酸性比Q的强
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X的单质是一种理想能源,X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.请回答下列问题:
-
(1) Y在元素周期表中的位置为.
-
(2) 上述元素中,非金属气态氢化物还原性最强的是(写化学式).Y和Z形成的含有共价键的化合物的电子式为.
-
(3) Y、G的单质或两元素之间形成的化合物可作水消毒剂的有.(写出其中两种物质的化学式).
-
(4) ZX与水剧烈反应产生X的单质,其化学方程式为.
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物溶于水溶液呈碱性,下列结论不正确的是( )
W | X | |
Y | Z |
A . X、Y、Z中最简单氢化物稳定性最弱的是Y
B . Z元素最高价氧化物对应水化物的酸性一定强于Y 元素最高价氧化物对应水化物的酸性
C . Z元素单质在化学反应中只表现氧化性
D . X、Y、Z元素形成的单核阴离子半径最大的是Y
短周期元素X最高氧化物对应的水化物为H3XO4 , 则它对应的气态氢化物( )
A . HX
B . H2X
C . XH4
D . XH3
已知115号元素的一种核素为289X,下列有关115号元素的有关叙述正确的是( )
A . 115号元素位于周期表第八周期
B . 该115号的元素的这种核素的原子中,中子数与电子数之差为174
C . 1个115号元素的原子与1个12C原子质量之比为115:12
D . 115号元素可显+5价
不能用元素周期律解释的是()
A . 酸性 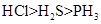 B . 原子半径
B . 原子半径 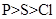 C . 最高正价
C . 最高正价 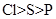 D . 酸性
D . 酸性 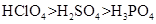
下列关于物质性质变化的比较,错误的是( )
A . 酸性强弱:HIO4>HBrO4>HClO4
B . 原子半径大小:Na>S>O
C . 碱性强弱:KOH>NaOH>LiOH
D . 金属性强弱:Na>Mg>Al
由三种短周期元素组成的盐A,按如下流程进行实验。溶液B中仅含有2种溶质,其中一种是酸式盐;气体C能使湿润的红色石蕊试纸变蓝。
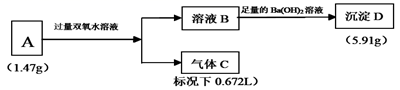
请回答:
-
(1) 气体C的名称为,A的化学式为。
-
(2) 固体A与足量双氧水反应的化学方程式是。
-
(3) 写出流程图中产生沉淀D的离子方程式。
短周期主族元素W、X、Y、Z的原子序数依次增大。工业上以金红石(主要成分是TiO2)为原料制备金属钛的步骤:①在高温下,向金红石与W的单质的混合物中通入Z的气体单质,得到化合物甲和化学式为WX的常见可燃性有毒气体乙,乙燃烧火焰呈蓝色;②在稀有气体环境和加热条件下,用Y的金属单质与甲反应可得钛,下列说法错误的是( )
A . 非金属性:Z>X>W
B . W与Z形成的化合物可用于工业上的重要有机溶剂
C . 简单离子半径:Z>X>Y
D . ZX2具有强氧化性,可用于饮用水消毒
X、Y、Z是短周期的三种主族元素,在周期表中的相对位置如图所示,下列说法正确的是( )
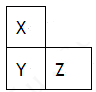
A . 原子半径:X<Y<Z
B . X、Y、Z三种元素的最高价氧化物对应水化物中最多有一种强酸
C . X的气态氢化物的稳定性比Y的气态氢化物强
D . 常温下X、Y、Z的单质不可能均与盐酸反应
短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素.Y的原子最外层电子数是其电子层数的3倍,W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是( )
A . 非金属性:Q>Y>X>Z
B . 简单气态氢化物的沸点:X>W
C . Y与X、Z、Q均可形成至少两种二元化合物
D . Y、Z、Q组成化合物的水溶液呈碱性
化合物  是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素,基态Z原子的核外电子位于5个不同的原子轨道中。下列说法正确的是( )
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素,基态Z原子的核外电子位于5个不同的原子轨道中。下列说法正确的是( )
 是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素,基态Z原子的核外电子位于5个不同的原子轨道中。下列说法正确的是( )
是一种高效消毒剂,其蒸汽和溶液都具有很强的杀菌能力,可用于新冠病毒疫情下的生活消毒。其中X、Y、Z 为原子序数依次增大的短周期元素,基态Z原子的核外电子位于5个不同的原子轨道中。下列说法正确的是( )
A . 该物质与医用酒精的杀菌原理相同
B . 元素的电负性:X<Y<Z
C . 最高正化合价:X<Y<Z
D . 该化合物中X、Y、Z均满足8电子稳定结构
下表是元素周期表短周期的一部分,请参照元素①~⑨在表中的位置,回答下列问题。
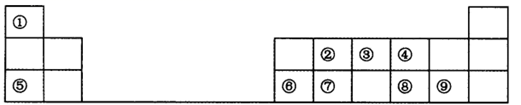
-
(1) 元素②在周期表中的位置是。
-
(2) 元素⑤和⑨形成的化合物的电子式为。
-
(3) 元素④、⑤、⑥形成的简单离子的半径依次(填“增大”“减小”或“不变”)。
-
(4) 表中元素②、③、⑦最高价含氧酸的酸性由强到弱的顺序是(填化学式)。
-
(5) 元素⑥形成的单质可与⑤的最高价氧化物对应的水化物发生反应,其反应的离子方程式为
-
(6) 在一定条件下,①与③可形成一种化合物X,其相对分子质量与O2相同,且X可在纯氧中燃烧,所得产物对环境均无污染,则X燃烧的化学方程式为
硒(34Se)是人体必需的微量元素,能有效提高人体免疫机能,预防癌症和心脑血管等疾病。下列有关硒元素的说法中不正确的是( )
A . Se 元素处于元素周期表中的第 15 列
B . Se 原子的价电子排布为 4s24p4
C . Se 元素处于元素周期表中的 p 区
D . 基态 Se 原子的核外电子排布中共有 8 个能级
短周期主族元素W、X、Y、Z的原子序数依次增大。A是元素Y的单质。常温下,A遇甲的浓溶液发生钝化。丙、丁、戊是由这些元素组成的二元化合物,丁和戊的组成元素相同,且丙是无色气体,上述物质的转化关系如图所示。下列说法正确的是( )
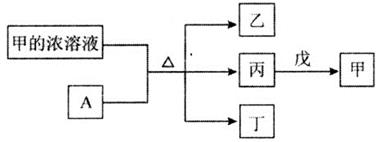
A . 简单氢化物的沸点:X>Z
B . 简单离子半径大小:X<Y
C . 丁分子和戊分子的空间结构相同
D . Y的简单离子与Z的简单离子在水溶液中可大量共存
下列有关性质的比较,错误的是( )
A . 金属性: 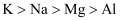 B . 碱性:
B . 碱性: 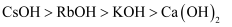 C . 酸性:
C . 酸性: 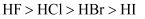 D . 沸点:
D . 沸点: 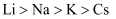
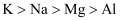 B . 碱性:
B . 碱性: 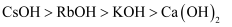 C . 酸性:
C . 酸性: 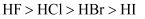 D . 沸点:
D . 沸点: 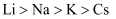
最近更新



