第一单元 氯气及氯的化合物 知识点题库

 3H2+CO,每消耗1molCH4转移12mol电子
B . 电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C . 电池工作时,CO32﹣向电极B移动
D . 电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
3H2+CO,每消耗1molCH4转移12mol电子
B . 电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C . 电池工作时,CO32﹣向电极B移动
D . 电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
-
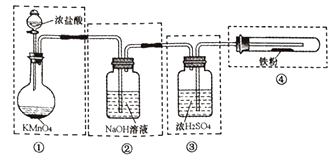
(1) [实验一]氯气的制取
该小组拟用下图实验装置来制备纯净、干燥的氯气,并完成与金属铁的反应(夹持仪器略去,下同)。每个虚线框表示一个单元装置,请用文字描述将下列装置的不符合题意之处改正。
-
(2) [实验二]探究氯化亚铁与氧气反应的产物
已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应,12FeCl2+3O2
 2Fe2O3+8FeCl3、4FeCl2+3O2
2Fe2O3+8FeCl3、4FeCl2+3O2  2Fe2O3+4Cl2 , 该化学小组选用下图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
2Fe2O3+4Cl2 , 该化学小组选用下图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。
实验装置的合理连接顺序为:A→→E。
-
(3) 假设加热装置中的完全反应,则反应后剩余固体的化学式是。请设计实验方案验证你的假设。
-
(4) 简述将F中的固体配成溶液的操作方法。
-
(5) [实验三]卤素化合物之间反应实验条件控制探究
在不同实验条件下KClO3可将KI 氧化为I2 或KIO3。下面是该小组设计的一组实验数据记录表(实验控制在室温下进行):
试管标号
1
2
3
4
0.20 mol· L-1KI 溶液/mL
1.0
1.0
1.0
1.0
KClO3(s)/g
0. 10
0. 10
0.10
0.10
6.0 mol· L-1 H2SO4溶液/mL
0
3.0
6.0
9.0
蒸馏水/mL
9.0
6.0
3.0
0
实验现象
①该组实验的目的是。
②2号试管反应完全后,取少量2号试管中的溶液滴加淀粉溶液后显蓝色,假设还原产物只有KCl,写出反应的离子方程式。

资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2 , 在碱性溶液中较稳定。
制备K2FeO4(夹持装置略)
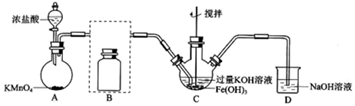
-
(1) A为氯气发生装置,A中反应离子方程式是:_。
-
(2) 将除杂装置B补充完整并标明所用试剂。_。
-
(3) C中得到紫色固体和溶液。C中Cl2发生的反应有:3Cl2+2Fe(OH)3+10KOH→2K2FeO4+6KCl+8H2O,另外还有:_。
-
(4) 已知Cl2与KOH在较高温度下反应生成KClO3。为了保证生产KClO,在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是:_、。
探究K2FeO4的性质
-
(5) 高铁酸钾常用于工业废水与城市生活污水的处理,可用作高效水处理剂,表现在水中与污染物作用的过程中,经过一系列反应,由六价降至三价后,能对水产生净化作用的原因是(结合离子方程式回答):。
-
(6) 取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2 , 为证明是否K2FeO4氧化了Cl-而产生Cl2 , 设计以下方案:
方案I
取少量a,滴加KSCN溶液至过量,溶液呈红色
方案II
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b,取少量b,滴加盐酸,有Cl2产生
i.由方案I中溶液变红可知a中含有离子,但该离子的产生不能判断一定K2FeO4将Cl-氧化,还可能由_产生(用离子方程式表示)。
ii.方案II可证明K2FeO4氧化了Cl-。
-
(7) 用KOH溶液洗涤的目的是_。
-
(8) 根据K2FeO4的制备实验得出:氧化性Cl2FeO42-(填“>”或“<”),而方案II实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是_。
-
(9) 资料表明,酸性溶液中的氧化性FeO42->MnO42- , 验证实验如下:
将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性FeO42->MnO42- , 若能,请说明理由;若不能,进一步设计实验方案,理由或方案:。
 ,而酸性高锰酸钾溶液的紫色会逐渐褪去。该氧化还原反应的体系中涉及
,而酸性高锰酸钾溶液的紫色会逐渐褪去。该氧化还原反应的体系中涉及  、
、  、
、  、
、  、
、  、
、 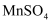 、
、  七种物质。
七种物质。
-
(1) 写出该氧化还原反应的化学方程式并配平:。
-
(2) 该反应中,化合价升高的反应物是,化合价没有发生变化的反应物是。氧化剂是,
 氧化剂在反应中(填“得到”或“失去”)
氧化剂在反应中(填“得到”或“失去”)  电子。
电子。
-
(3) 如果在反应后的溶液中加入
 ,溶液又变为紫色。由此推测
,溶液又变为紫色。由此推测  的具有较强的性。
的具有较强的性。
 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
-
(1) 在方程式上用双线桥标出电子转移的方向和数目
-
(2) Cu 作剂,硫元素被(填“氧化”或“还原”,下同),发生反应。
 和 Pb2+ , 则与 10 个 Cr3+反应所需 PbO2 的个数为( )
和 Pb2+ , 则与 10 个 Cr3+反应所需 PbO2 的个数为( )
-
(1) Cl2与NaClO2溶液反应可制取ClO2和NaCl。该反应中氧化剂与还原剂物质的量之比为。
-
(2) Cl2与ClO2均具有杀菌能力。ClO2杀菌效率是Cl2的倍(已知杀菌效率是指单位质量的氧化剂得电子数目的多少,结果保留三位有效数字。)
-
(3) 已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 向NaClO2溶液中滴加盐酸,反应剧烈,若将盐酸换成等c(H+)的硫酸,开始反应缓慢,稍后一段时间产生气体迅速加快,产生这种现象可能的原因是。
-
(4) ClO2易分解,为了运输和贮存常将其制成NaClO2固体。反应原理为2ClO2+2NaOH+H2O2=2NaClO2+2H2O+O2↑,某同学模拟工业制NaClO2 , 其装置如图所示:

①仪器a的名称是,装置B的作用是。
②装置A中反应生成KHCO3和ClO2 , 写出该反应的化学方程式:。
③已知饱和NaClO2溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,在温度高于38℃时析出的晶体是NaClO2 , 设计从NaClO2溶液中制取晶体NaClO2的操作:。

-
(1) “喷淋液”中的ClO2可通过下述方法制备:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
当生成1 mol ClO2时,转移的电子为mol。
-
(2) 所得副产物中除了NH4Cl外,还有(填化学式)。
-
(3) 传统湿式氨法烟气处理技术以氨水作为喷淋液,在催化剂作用下,喷淋除去NO过程中有一种无污染气体生成。该反应的化学方程式为。
-
(4) 利用ClO2协同氨水进行脱硫脱硝净化时,NO和SO2气体脱除效率随pH变化情况如图1所示,ClO2被还原为ClO2-、Cl-的转化率与溶液pH的关系如图2所示。

①NO的脱除率随着pH的增大而逐渐减弱,可能原因是。
②写出pH≤2.0时,ClO2脱除SO2反应的离子方程式:。
 ;电池工作时,下列说法正确的是( )
;电池工作时,下列说法正确的是( )

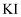 溶液、
溶液、  溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
溶液的试管中,对比观察。通过此实验能够观察到的现象或得出的结论正确的是( )
 C . 可证明氧化性强弱:
C . 可证明氧化性强弱:  D . 可证明
D . 可证明  的氧化性强于
的氧化性强于  和
和 

据此回答下列问题:
-
(1) 试剂X的成分是,盛放盐酸的仪器名称是,C中除观察到有气泡产生外,还可观察到的现象是。
-
(2) D装置用于收集Cl2 , a、b两导管长度需要修改,修改的方法是,F中反应的离子方程式为。
-
(3) 装置E的作用是验证氯气无漂白性但在水溶液中有漂白性,则装置中Ⅰ、Ⅱ、Ⅲ处依次应放入的物质是,相应的实验现象是。
序号
Ⅰ
Ⅱ
Ⅲ
a
干燥的石蕊试纸
碱石灰
湿润的石蕊试纸
b
干燥的石蕊试纸
无水氯化钙
湿润的石蕊试纸
c
湿润的石蕊试纸
浓硫酸
干燥的石蕊试纸
d
湿润的石蕊试纸
干燥的石蕊试纸
-
(4) 写出制备氯气的化学方程式,如果将40 mL、10 mol/L的浓盐酸与足量MnO2充分反应,实际能收集到的氯气在标准状况下的体积为。
A.2.24 L B.>2.24 L C.<2.24 L
 B .
B .  C .
C .  D .
D . 



