第дёҖеҚ•е…ғ ж°Ҝж°”еҸҠж°Ҝзҡ„еҢ–еҗҲзү© зҹҘиҜҶзӮ№йўҳеә“
ClO2йҒҮжө“зӣҗй…ёдјҡз”ҹжҲҗCl2 пјҢ еҸҚеә”ж–№зЁӢејҸдёә2ClO2+8HCl=5Cl2+4H2OпјҢиҜҘеҸҚеә”дёӯиӢҘиҪ¬з§»з”өеӯҗзҡ„ж•°зӣ®дёә9.632Г—1023 пјҢ еҲҷдә§з”ҹзҡ„Cl2еңЁж ҮеҶөдёӢзҡ„дҪ“з§ҜдёәпјҲгҖҖгҖҖпјү
A . 11.2L
B . 33.6L
C . 22.4L
D . 44.8L
дёӢеҲ—зү©иҙЁж—ўиғҪз”ұйҮ‘еұһе’Ңй…ёеҸҚеә”иҺ·еҫ—пјҢд№ҹиғҪйҖҡиҝҮйҮ‘еұһе’Ңж°Ҝж°”еҸҚеә”иҺ·еҫ—зҡ„жҳҜпјҲВ В пјү
A . CuCl2
B . FeCl2
C . FeCl3
D . AlCl3
иғҪдҪҝе№ІзҮҘжңүиүІеёғжқЎиӨӘиүІзҡ„зү©иҙЁжҳҜпјҲ пјү
A . ж°Ҝж°”
B . ж°ҜеҢ–ж°ў
C . ж°Ҝж°ҙ
D . ж°ўж°§еҢ–й’
0.1molH2е’ҢCl2з»„жҲҗзҡ„ж··еҗҲж°”дҪ“пјҢе…¶дёӯCl2зҡ„дҪ“з§ҜеҲҶж•°дёә70%пјҢе…үз…§е……еҲҶеҸҚеә”еҗҺпјҢе°ҶжүҖеҫ—зҡ„ж··еҗҲж°”дҪ“зј“ж…ўйҖҡе…Ҙеҗ«жңү0.15molNaOHзҡ„жә¶ж¶Ідёӯе……еҲҶеҸҚеә”пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
A . е…үз…§д»ҘеҗҺпјҢжүҖеҫ—ж··еҗҲж°”дҪ“дёӯеҗ«жңү0.07 molHCl
B . е…үз…§д»ҘеҗҺпјҢжүҖеҫ—ж··еҗҲж°”дҪ“дҪ“з§Ҝе°ҸдәҺеҺҹж··еҗҲж°”дҪ“дҪ“з§ҜпјҲзӣёеҗҢжқЎд»¶дёӢпјү
C . жңҖз»ҲжүҖеҫ—жә¶ж¶ІдёӯпјҢNaClе’ҢNaClOзҡ„зү©иҙЁзҡ„йҮҸжҜ”дёә5пјҡ2
D . жңҖз»ҲжүҖеҫ—жә¶ж¶ІдёӯпјҢиҝҳеҗ«жңү0.02 molNaOH
жұҪиҪҰеү§зғҲзў°ж’һж—¶пјҢе®үе…Ёж°”еӣҠдёӯеҸ‘з”ҹеҸҚеә”пјҡ10NaN3пјӢ2KNO3 = K2OпјӢ5Na2OпјӢ16N2вҶ‘дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
A . KNO3жҳҜиҝҳеҺҹеүӮпјҢе…¶дёӯж°®е…ғзҙ иў«ж°§еҢ–
B . з”ҹжҲҗзү©дёӯзҡ„N2жҳҜж°§еҢ–дә§зү©пјҢK2OжҳҜиҝҳеҺҹдә§зү©
C . жҜҸиҪ¬з§»1 molз”өеӯҗпјҢеҸҜз”ҹжҲҗN2зҡ„дҪ“з§Ҝдёә35.84 L
D . иӢҘжңү65 g NaN3еҸӮеҠ еҸҚеә”пјҢеҲҷиў«ж°§еҢ–зҡ„Nзҡ„зү©иҙЁзҡ„йҮҸдёә3 mol
еҰӮжһңеҸҚеә”4P + 3KOH + 3H2O = 3KH2PO2 + PH3дёӯиҪ¬з§»0.6molз”өеӯҗпјҢж¶ҲиҖ—KOHзҡ„иҙЁйҮҸдёәпјҲ пјү
A . 5.6е…Ӣ
B . 16.8е…Ӣ
C . 33.6е…Ӣ
D . 100.8е…Ӣ
дёӢеҲ—е®һйӘҢиЈ…зҪ®иғҪиҫҫеҲ°зӣ®зҡ„пјҲ пјү
A . 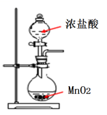 иЈ…зҪ®з”ЁдәҺе®һйӘҢе®ӨеҲ¶еӨҮж°Ҝж°”
B .
иЈ…зҪ®з”ЁдәҺе®һйӘҢе®ӨеҲ¶еӨҮж°Ҝж°”
B . 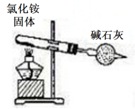 иЈ…зҪ®е®һйӘҢе®ӨеҲ¶ж°Ёж°”
C .
иЈ…зҪ®е®һйӘҢе®ӨеҲ¶ж°Ёж°”
C . 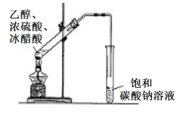 иЈ…зҪ®з”ЁдәҺе®һйӘҢе®ӨеҲ¶д№ҷй…ёд№ҷй…Ҝ
D .
иЈ…зҪ®з”ЁдәҺе®һйӘҢе®ӨеҲ¶д№ҷй…ёд№ҷй…Ҝ
D . 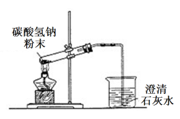 иЈ…зҪ®еҸҜиҝӣиЎҢзўій…ёж°ўй’ еҸ—зғӯеҲҶи§Ј
иЈ…зҪ®еҸҜиҝӣиЎҢзўій…ёж°ўй’ еҸ—зғӯеҲҶи§Ј
 иЈ…зҪ®з”ЁдәҺе®һйӘҢе®ӨеҲ¶еӨҮж°Ҝж°”
B .
иЈ…зҪ®з”ЁдәҺе®һйӘҢе®ӨеҲ¶еӨҮж°Ҝж°”
B .  иЈ…зҪ®е®һйӘҢе®ӨеҲ¶ж°Ёж°”
C .
иЈ…зҪ®е®һйӘҢе®ӨеҲ¶ж°Ёж°”
C .  иЈ…зҪ®з”ЁдәҺе®һйӘҢе®ӨеҲ¶д№ҷй…ёд№ҷй…Ҝ
D .
иЈ…зҪ®з”ЁдәҺе®һйӘҢе®ӨеҲ¶д№ҷй…ёд№ҷй…Ҝ
D .  иЈ…зҪ®еҸҜиҝӣиЎҢзўій…ёж°ўй’ еҸ—зғӯеҲҶи§Ј
иЈ…зҪ®еҸҜиҝӣиЎҢзўій…ёж°ўй’ еҸ—зғӯеҲҶи§Ј
еҫҖFeBr2жә¶ж¶ІдёӯйҖҡе…ҘCl2ж—¶пјҢйҡҸеҸӮеҠ еҸҚеә”Cl2зү©иҙЁзҡ„йҮҸзҡ„еҸҳеҢ–пјҢжә¶ж¶ІдёӯжҹҗдәӣзҰ»еӯҗзҡ„жө“еәҰеҸҳеҢ–жғ…еҶөеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү

A . еҪ“n(Cl2)пјңM molж—¶пјҢеҸ‘з”ҹзҡ„зҰ»еӯҗеҸҚеә”пјҡ2Fe2пјӢпјӢCl2=2Fe3пјӢпјӢ2ClвҖ•
B . еҪ“n(Cl2)пјқM molж—¶пјҢзҰ»еӯҗжө“еәҰе…ізі»пјҡc(Fe3пјӢ)пё°c(BrпјҚ)пё°c(ClпјҚ)пјқ1пё°2пё°2
C . еҪ“n(Cl2)пјқ2M molж—¶пјҢзҰ»еӯҗжө“еәҰеӨ§е°Ҹе…ізі»пјҡc(ClпјҚ)пјһc(BrпјҚ)
D . еҪ“BrвҖ•ејҖе§Ӣиў«ж°§еҢ–ж—¶пјҢйҖҡе…ҘCl2зҡ„зү©иҙЁзҡ„йҮҸе°ҸдәҺеҺҹFeBr2зҡ„зү©иҙЁзҡ„йҮҸ
е·ІзҹҘQдёҺRзҡ„ж‘©е°”иҙЁйҮҸд№ӢжҜ”дёә9вҲ¶22пјҢеңЁеҸҚеә”X+2Y=2Q +RдёӯпјҢеҪ“1.6gXдёҺдёҖе®ҡйҮҸYе®Ңе…ЁеҸҚеә”еҗҺпјҢз”ҹжҲҗ4.4gRпјҢеҲҷеҸӮдёҺеҸҚеә”зҡ„Yе’Ңз”ҹжҲҗзү©Qзҡ„иҙЁйҮҸд№ӢжҜ”дёәпјҲ пјү
A . 46вҲ¶9
B . 32вҲ¶9
C . 23вҲ¶9
D . 16вҲ¶9
2008е№ҙиҙЁжЈҖйғЁй—ЁеңЁдј—еӨҡе“ҒзүҢд№іеҲ¶е“ҒдёӯжЈҖеҮәжңүжҜ’жңүжңәзү©дёүиҒҡж°°иғә[C3N3(NH2)3]пјҢеңЁд№іеҲ¶е“ҒиЎҢдёҡжҺҖиө·дәҶдёҖеңәиҪ©з„¶еӨ§жіўпјҢеј•еҸ‘дәҶдёҖеңәе…ідәҺйЈҹе“Ғе®үе…Ёй—®йўҳзҡ„еӨ§и®Ёи®әгҖӮдёүиҒҡж°°иғәжҳҜдёҖз§ҚйҮҚиҰҒзҡ„жңүжңәеҢ–е·ҘеҺҹж–ҷпјҢеӣ е…¶еҗ«ж°®йҮҸй«ҳиҖҢиў«дёҚжі•е•Ҷ家用дҪңйЈҹе“Ғж·»еҠ еүӮпјҢд»ҘжҸҗеҚҮйЈҹе“ҒжЈҖжөӢдёӯзҡ„иӣӢзҷҪиҙЁеҗ«йҮҸжҢҮж ҮпјҲN%пјүпјҢеӣ жӯӨдёүиҒҡж°°иғәд№ҹиў«дәәз§°дёәвҖңиӣӢзҷҪзІҫвҖқгҖӮдёүиҒҡж°°иғәйҒҮејәй…ёжҲ–ејәзўұж°ҙжә¶ж¶Іж°ҙи§ЈпјҢиғәеҹәйҖҗжӯҘиў«зҫҹеҹәеҸ–д»ЈпјҢжңҖеҗҺз”ҹжҲҗдёүиҒҡж°°й…ё[C3N3(OH)3]гҖӮдёүиҒҡж°°й…ёеҸҜз”ЁдәҺж¶ҲйҷӨжұҪиҪҰе°ҫж°”дёӯзҡ„NO2гҖӮе…¶еҸҚеә”еҺҹзҗҶдёәпјҡ  пјӣ
пјӣ  пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 пјӣ
пјӣ  пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . C3N3(OH)3дёҺHNCOдёәеҗҢдёҖзү©иҙЁ
B . HNCOжҳҜдёҖз§ҚеҫҲејәзҡ„ж°§еҢ–еүӮ
C . 1mol NO2еңЁеҸҚеә”дёӯиҪ¬з§»зҡ„з”өеӯҗдёә4mol
D . еҸҚеә”дёӯNO2жҳҜиҝҳеҺҹеүӮ
еңЁеҸҚеә”3BrF3пјӢ5H2O=HBrO3пјӢBr2пјӢ9HFпјӢO2вҶ‘дёӯпјҢиӢҘжңү5 mol H2OдҪңдёәиҝҳеҺҹеүӮж—¶пјҢиў«иҝҳеҺҹзҡ„BrF3зҡ„зү©иҙЁзҡ„йҮҸдёә( )
A . 3 mol
B . 2 mol
C . 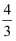 mol
D .
mol
D . 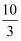 mol
mol
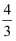 mol
D .
mol
D . 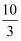 mol
mol
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . еңЁеҜҶй—ӯе®№еҷЁдёӯпјҢдҪҝ1molN2е’Ң3molH2е……еҲҶеҸҚеә”еҗҺз”ҹжҲҗNH3зҡ„еҲҶеӯҗж•°дёә2NA
B . ж ҮеҮҶзҠ¶еҶөдёӢпјҢ0.56 L дёҷзғ·дёӯеҗ«жңүе…ұд»·й”®зҡ„ж•°зӣ®дёә0.2NA
C . 2g H218Oе’ҢD2O зҡ„ж··еҗҲзү©дёӯпјҢеҗ«жңүзҡ„дёӯеӯҗж•°дёәNA
D . иӢҘ1mol ж°ҜеҢ–й“Ғе®Ңе…ЁиҪ¬еҢ–дёәж°ўж°§еҢ–й“Ғиғ¶дҪ“пјҢеҲҷеҲҶж•Јзі»дёӯиғ¶дҪ“еҫ®зІ’ж•°дёәNA
ClO2 дёҺ Cl2 зҡ„ж°§еҢ–жҖ§зӣёиҝ‘гҖӮеңЁиҮӘжқҘж°ҙж¶ҲжҜ’е’Ңжһң蔬дҝқйІңзӯүж–№йқўеә”з”Ёе№ҝжіӣгҖӮжҹҗе…ҙи¶Је°Ҹ з»„йҖҡиҝҮеӣҫ1 иЈ…зҪ®(еӨ№жҢҒиЈ…зҪ®з•Ҙ)еҜ№е…¶еҲ¶еӨҮгҖҒеҗёж”¶гҖҒйҮҠж”ҫе’Ңеә”з”ЁиҝӣиЎҢдәҶз ”з©¶гҖӮ


-
пјҲ1пјү д»ӘеҷЁ D зҡ„еҗҚз§°жҳҜгҖӮе®үиЈ… F дёӯеҜјз®Ўж—¶,еә”йҖүз”Ёеӣҫ2дёӯзҡ„гҖӮ
-
пјҲ2пјү жү“ејҖ B зҡ„жҙ»еЎһ,A дёӯеҸ‘з”ҹеҸҚеә”:2NaClO3+4HCl
 2ClO2вҶ‘+Cl2вҶ‘+2NaCl+2H2OгҖӮдёәдҪҝ ClO2 еңЁ D дёӯиў«зЁіе®ҡеүӮе…… еҲҶеҗёж”¶,ж»ҙеҠ зЁҖзӣҗй…ёзҡ„йҖҹеәҰе®ң (еЎ«вҖңеҝ«вҖқжҲ–вҖңж…ўвҖқ)гҖӮ
2ClO2вҶ‘+Cl2вҶ‘+2NaCl+2H2OгҖӮдёәдҪҝ ClO2 еңЁ D дёӯиў«зЁіе®ҡеүӮе…… еҲҶеҗёж”¶,ж»ҙеҠ зЁҖзӣҗй…ёзҡ„йҖҹеәҰе®ң (еЎ«вҖңеҝ«вҖқжҲ–вҖңж…ўвҖқ)гҖӮ
-
пјҲ3пјү е…ій—ӯ B зҡ„жҙ»еЎһ,ClO2 еңЁ D дёӯиў«зЁіе®ҡеүӮе®Ңе…Ёеҗёж”¶з”ҹжҲҗ NaClO2,жӯӨж—¶ F дёӯжә¶ж¶Ізҡ„йўңиүІдёҚеҸҳ,еҲҷиЈ…зҪ® C зҡ„дҪңз”ЁжҳҜ гҖӮ
-
пјҲ4пјү е·ІзҹҘеңЁй…ёжҖ§жқЎд»¶дёӢ NaClO2 еҸҜеҸ‘з”ҹеҸҚеә”з”ҹжҲҗ NaCl 并йҮҠж”ҫеҮә ClO2,иҜҘеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә,еңЁ ClO2 йҮҠж”ҫе®һйӘҢдёӯ,жү“ејҖ E зҡ„жҙ»еЎһ,D дёӯеҸ‘з”ҹеҸҚеә”,еҲҷиЈ…зҪ® Fзҡ„дҪңз”ЁжҳҜ гҖӮ
дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . е·ҘдёҡдёҠд»Ҙж°Ҝж°”е’ҢзҹізҒ°д№ідёәеҺҹж–ҷеҲ¶еҸ–жјӮзҷҪзІү
B . 75% (дҪ“з§ҜеҲҶж•°)й…’зІҫжә¶ж¶ІиғҪдҪҝиӣӢзҷҪиҙЁеҸҳжҖ§пјҢе…¶ж¶ҲжҜ’ж•ҲжһңжҜ”ж— ж°ҙй…’зІҫеҘҪ
C . й’ жҳҜдёҖз§ҚејәиҝҳеҺҹеүӮпјҢеҸҜз”ЁдәҺеҲ¶еҸ–й’ӣгҖҒй“ҢзӯүйҮ‘еұһ
D . еңЁе·ҘдёҡзӮјй“ҒдёӯпјҢз„ҰзӮӯзҡ„дҪңз”ЁжҳҜзӣҙжҺҘиҝҳеҺҹй“Ғзҹҝзҹі
дёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . ж°Ҝж°”еҸҜз”ЁдәҺиҮӘжқҘж°ҙзҡ„ж¶ҲжҜ’
B . дәҢж°§еҢ–зЎ…жҳҜеҚҠеҜјдҪ“жқҗж–ҷ
C . ж°ўж°§еҢ–й“Ғиғ¶дҪ“иғҪз”ЁдәҺеҮҖж°ҙ
D . дәҢж°§еҢ–зЎ«еҸҜз”ЁдәҺжјӮзҷҪзәёжөҶ
е·ҘдёҡдёҠеҸҜеҲ©з”ЁFeCl3жә¶ж¶Іи…җиҡҖй“ңз®”зҡ„еҺҹзҗҶеҲ¶йҖ еҚ°еҲ·зәҝи·ҜжқҝгҖӮе°ҶдёҖеқ—й“ңз®”ж”ҫе…Ҙ500mL1.0mol/Lзҡ„FeCl3жә¶ж¶ІдёӯпјҢз»ҸиҝҮдёҖж®өж—¶й—ҙеҗҺеҲ¶жҲҗдәҶеҚ°еҲ·зәҝи·ҜжқҝгҖӮдёӢеҲ—дёҺжӯӨжңүе…ізҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
A . CuжҳҜиҝҳеҺҹеүӮпјҢFeCl3жҳҜж°§еҢ–еүӮ
B . и…җиҡҖж¶ІдёӯCl-зҡ„жө“еәҰжҳҺжҳҫеҮҸе°Ҹ
C . и…җиҡҖж¶Ізҡ„ж°§еҢ–жҖ§еўһејә
D . иҪ¬з§»зҡ„з”өеӯҗдёҖе®ҡжҳҜ0.50mol
еҢ–еӯҰеҸҚеә”з»ҸеёёдјҙйҡҸзқҖйўңиүІеҸҳеҢ–пјҢдёӢеҲ—е…ідәҺйўңиүІзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲ пјү
в‘ йёЎиӣӢзҷҪжә¶ж¶ІйҒҮжө“зЎқй…ёвҖ”вҖ”й»„иүІ
в‘Ўж·ҖзІүжә¶ж¶ІйҒҮзўҳзҰ»еӯҗвҖ”вҖ”и“қиүІ
в‘ўзғӯзҡ„ж°§еҢ–й“ңйҒҮд№ҷйҶҮвҖ”вҖ”зәўиүІ
в‘Јж–°еҲ¶ж°Ҝж°ҙд№…зҪ®еҗҺвҖ”вҖ”ж— иүІ
в‘ӨиҝҮж°§еҢ–й’ еңЁз©әж°”дёӯд№…зҪ®вҖ”вҖ”ж·Ўй»„иүІ
в‘ҘFe3+зҰ»еӯҗйҒҮиӢҜй…ҡвҖ”вҖ”зҙ«иүІ
в‘Ұзҹіи•ҠиҜ•ж¶ІдёӯйҖҡдәҢж°§еҢ–зЎ«ж°”дҪ“вҖ”вҖ”ж— иүІ
A . в‘ в‘Ўв‘ўв‘Ұ
B . в‘Ўв‘ўв‘Јв‘Ҙ
C . в‘ в‘ўв‘Јв‘Ҙ
D . в‘Ўв‘Јв‘Өв‘Ұ
иөӨй“ңзҹҝзҡ„дё»иҰҒжҲҗеҲҶжҳҜCu2OпјҢиҫүй“ңзҹҝзҡ„дё»иҰҒжҲҗеҲҶжҳҜCu2SпјҲSдёәпјҚ2д»·пјүпјҢе°ҶиөӨй“ңзҹҝдёҺиҫүй“ңзҹҝж··еҗҲеҠ зғӯеҸ‘з”ҹд»ҘдёӢеҸҚеә”пјҡCu2SпјӢ2Cu2O 6CuпјӢSO2вҶ‘пјҢдёӢеҲ—иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲ пјү
6CuпјӢSO2вҶ‘пјҢдёӢеҲ—иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲ пјү
 6CuпјӢSO2вҶ‘пјҢдёӢеҲ—иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲ пјү
6CuпјӢSO2вҶ‘пјҢдёӢеҲ—иҜҙжі•дёӯй”ҷиҜҜзҡ„жҳҜпјҲ пјү
A . еңЁCu2OгҖҒCu2SдёӯCuе…ғзҙ еҢ–еҗҲд»·йғҪжҳҜпјӢ1д»·
B . еҸҚеә”дёӯCuе…ғзҙ иў«ж°§еҢ–пјҢSе…ғзҙ иў«иҝҳеҺҹ
C . Cu2SеңЁеҸҚеә”дёӯж—ўжҳҜж°§еҢ–еүӮпјҢеҸҲжҳҜиҝҳеҺҹеүӮ
D . жҜҸз”ҹжҲҗ1дёӘSO2еҲҶеӯҗпјҢеҸҚеә”дёӯиҪ¬з§»6дёӘз”өеӯҗ
е°Ҷ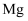 гҖҒ
гҖҒ з»„жҲҗзҡ„
з»„жҲҗзҡ„ ж··еҗҲзү©жҠ•е…ҘйҖӮйҮҸзЁҖзЎқй…ёдёӯжҒ°еҘҪеҸҚеә”пјҢеӣәдҪ“е®Ңе…Ёжә¶и§Јж—¶ж”¶йӣҶеҲ°е”ҜдёҖиҝҳеҺҹдә§зү©
ж··еҗҲзү©жҠ•е…ҘйҖӮйҮҸзЁҖзЎқй…ёдёӯжҒ°еҘҪеҸҚеә”пјҢеӣәдҪ“е®Ңе…Ёжә¶и§Јж—¶ж”¶йӣҶеҲ°е”ҜдёҖиҝҳеҺҹдә§зү© ж°”дҪ“
ж°”дҪ“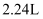 (ж ҮеҮҶзҠ¶еҶө)пјҢеҗ‘еҸҚеә”еҗҺжә¶ж¶ІдёӯеҠ е…ҘдёҖе®ҡйҮҸзҡ„
(ж ҮеҮҶзҠ¶еҶө)пјҢеҗ‘еҸҚеә”еҗҺжә¶ж¶ІдёӯеҠ е…ҘдёҖе®ҡйҮҸзҡ„ жә¶ж¶ІпјҢйҮ‘еұһзҰ»еӯҗжҒ°еҘҪжІүж·Җе®Ңе…ЁгҖӮеҲҷеҪўжҲҗжІүж·ҖиҙЁйҮҸдёәпјҲ пјү
жә¶ж¶ІпјҢйҮ‘еұһзҰ»еӯҗжҒ°еҘҪжІүж·Җе®Ңе…ЁгҖӮеҲҷеҪўжҲҗжІүж·ҖиҙЁйҮҸдёәпјҲ пјү
 гҖҒ
гҖҒ з»„жҲҗзҡ„
з»„жҲҗзҡ„ ж··еҗҲзү©жҠ•е…ҘйҖӮйҮҸзЁҖзЎқй…ёдёӯжҒ°еҘҪеҸҚеә”пјҢеӣәдҪ“е®Ңе…Ёжә¶и§Јж—¶ж”¶йӣҶеҲ°е”ҜдёҖиҝҳеҺҹдә§зү©
ж··еҗҲзү©жҠ•е…ҘйҖӮйҮҸзЁҖзЎқй…ёдёӯжҒ°еҘҪеҸҚеә”пјҢеӣәдҪ“е®Ңе…Ёжә¶и§Јж—¶ж”¶йӣҶеҲ°е”ҜдёҖиҝҳеҺҹдә§зү©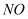 ж°”дҪ“
ж°”дҪ“ (ж ҮеҮҶзҠ¶еҶө)пјҢеҗ‘еҸҚеә”еҗҺжә¶ж¶ІдёӯеҠ е…ҘдёҖе®ҡйҮҸзҡ„
(ж ҮеҮҶзҠ¶еҶө)пјҢеҗ‘еҸҚеә”еҗҺжә¶ж¶ІдёӯеҠ е…ҘдёҖе®ҡйҮҸзҡ„ жә¶ж¶ІпјҢйҮ‘еұһзҰ»еӯҗжҒ°еҘҪжІүж·Җе®Ңе…ЁгҖӮеҲҷеҪўжҲҗжІүж·ҖиҙЁйҮҸдёәпјҲ пјү
жә¶ж¶ІпјҢйҮ‘еұһзҰ»еӯҗжҒ°еҘҪжІүж·Җе®Ңе…ЁгҖӮеҲҷеҪўжҲҗжІүж·ҖиҙЁйҮҸдёәпјҲ пјү
A . 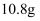 B .
B . 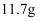 C .
C .  D .
D . 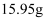
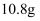 B .
B . 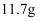 C .
C .  D .
D . 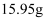
ж°”дҪ“Xзҡ„дё»иҰҒжҲҗеҲҶжҳҜCl2(еҗ«жңүе°‘йҮҸж°ҙи’ёж°”)пјҢжҹҗеӯҰд№ е°Ҹз»„з”ЁеҰӮеӣҫиЈ…зҪ®з ”究气дҪ“Xзҡ„жҖ§иҙЁгҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ

-
пјҲ1пјү Cдёӯзҡ„зҺ°иұЎжҳҜпјӣз»“еҗҲеҢ–еӯҰж–№зЁӢејҸиҜҙжҳҺBгҖҒCдёӯзҺ°иұЎдёҚеҗҢзҡ„еҺҹеӣ гҖӮ
-
пјҲ2пјү йңҖиҰҒеңЁDеӨ„иҝһжҺҘеҰӮеӣҫжүҖзӨәиЈ…зҪ®пјҢж°”дҪ“еә”иҜҘз”ұ(еЎ«вҖңaвҖқжҲ–вҖңbвҖқ)з®ЎйҖҡе…ҘгҖӮиҜҘиЈ…зҪ®зҡ„дҪңз”ЁжҳҜпјҢз”ЁзҰ»еӯҗж–№зЁӢејҸиЎЁзӨәе…¶еҺҹзҗҶгҖӮ

жңҖиҝ‘жӣҙж–°



