固体溶解度的概念 知识点题库
在一定温度下,向15g蒸馏水加入无水硫酸铜粉末,充分搅拌并过滤,得到一定质量的蓝色五水合硫酸铜晶体和8.4g滤液,若此温度下无水硫酸铜的溶解度为40g,则此无水硫酸铜的质量是.
在20℃时,100g水中最多可溶解A物质50g;在60℃时,100g水中最多可溶解B物质100g,则A、B 两种物质的溶解度大小比较为( )
A . 无法比较
B . A=B
C . A<B
D . A>B
20℃时,取氯酸钾、硝酸钾、氯化钠、蔗糖各10g,分别加入50g水中(相关溶解度数据见表),充分溶解后有固体剩余的是( )
物质 | 氯酸钾 | 硝酸钾 | 氯化钠 | 蔗糖 |
20℃时溶解度/g | 7.4 | 31.6 | 36.0 | 203.9 |
A . 氯酸钾
B . 硝酸钾
C . 氯化钠
D . 蔗糖
根据如表回答相关问题.
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g/100g水) | KNO3 | 13.3 | 31.6 | 63.9 | 110.0 | 169.0 | 246.0 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 | |
①表中两种物质的溶解度相等的温度范围是在℃.
②20℃时,硝酸钾的溶解度是31.6g/100g水,其含义是.该温度下,将20gKNO3放入50g水中,充分搅拌,所得溶液的质量是 g.要进一步提高该溶液的溶质质量分数,可进行的操作是.
③硝酸钾溶液中含有少量氯化钠杂质,提纯的方法是.
④60℃时,对100g硝酸钾饱和溶液(如A烧杯)进行如下操作,请回答相关问题:
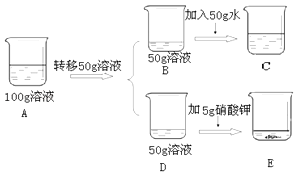
上述溶液中所含溶质的质量DE(填“>”或“<”或“=”,下同),溶液不饱和的是(用A,B,C,D,E填空),溶液B,C,E中溶质质量分数的大小关系是.
20℃时,取甲、乙、丙、丁四种纯净物各 20g,分别加入到四个各盛有 50g 水的烧杯中,充分溶解,其溶解情况如下表:
物质 | 甲 | 乙 | 丙 | 丁 |
未溶解固体的质量/g | 4.2 | 2 | 0 | 9.2 |
下列说法正确的是( )
A . 所得四杯溶液都是饱和溶液
B . 丁溶液的溶质质量分数最大
C . 20℃时四种物质溶解度的关系为:丙>乙>甲>丁
D . 四杯溶液中溶剂的质量大小为:丙溶液>乙溶液>甲溶液>丁溶液
下列说法正确的是( )
A . 在一定温度下,一定量的水中可以无限制溶解食盐
B . 温度越高,物质的溶解能力越强
C . 所有物质都能溶于水
D . 气体的溶解性受温度影响
在t ℃时,某A物质的溶液先恒温蒸发10克水,析出2克无水晶体,再恒温蒸发20克水,析出5克无水晶体,下列说法正确的是( )
A . t ℃时,原溶液是饱和溶液
B . t ℃时,A物质的溶解度是20克
C . t ℃时,A物质的溶解度为25克
D . t ℃时,A物质的溶解度为30克
20℃时,取下表中的四种物质各 20 克,加入到 100 克水中充分溶解后,有固体剩余的是( )
常见物质的溶解度(20℃) | ||||
物质名称 | 氯酸钾 | 硝酸钾 | 氯化钠 | 蔗糖 |
溶解度/克 | 7.4 | 31.6 | 36.0 | 203.9 |
A . 氯酸钾
B . 硝酸钾
C . 氯化钠
D . 蔗糖
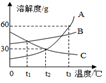
如图所示是A、B、C三种固体物质的溶解度曲线.完成下列问题.
-
(1) 在℃时,B、C两种物质的溶解度相等.
-
(2) 将t3℃时A物质饱和溶液降至t2℃.所得溶液中溶质与溶剂的质量比为.
-
(3) 若A中有少量B时,采取 的结晶方式提纯A.
-
(4) t3℃时,将等质量的A、B、C三种物质配制成饱和溶液,所需水的质量由多到少的顺序是(用A、B、C表示).
下表是硝酸钾、氯化钠在不同温度下的溶解度。
|
温度/℃ |
10 |
20 |
30 |
40 |
50 |
|
硝酸钾的溶解度/g |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
|
氯化钠的溶解度/g |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
-
(1) 从表中数据分析,硝酸钾和氯化钠溶解度曲线的交点在(填温度)之间;
-
(2) 当硝酸钾中混有少量氯化钠时,提纯硝酸钾所采用的方法为。
20℃时,向一盛有40g氯化钠的烧杯内加入100g水,充分搅拌后静置,烧杯底部仍有未溶解的氯化钠固体,过滤得到4g固体和澄清溶液。下列有关叙述错误的是( )
A . 该溶液中溶质的质量等于36g
B . 20℃时氯化钠在水中的溶解度为36g
C . 该溶液中溶质的质量分数等于36%
D . 加水后该溶液变为不饱和溶液
硫酸镁在工农业以及医疗上有广泛应用,其溶解度如表所示.则下列说法正确的是( )
| 温度/℃ | 10 | 30 | 50 | 70 | 90 |
| 溶解度/g | 27.7 | 39.3 | 49.0 | 54.1 | 51.1 |
A . 硫酸镁的溶解度随温度升高而减小
B . 10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液
C . 50℃时,100g硫酸镁饱和溶液中溶质和溶剂的质量比为49:100
D . 70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数不变
如图是甲、乙两种固体物质的溶解度曲线。下列叙述正确的是( )

A . 甲的溶解度大于乙的溶解度
B . t1℃时,甲、乙的饱和溶液溶质的质量分数均为30%
C . t2℃时,N点表示甲物质的不饱和溶液
D . 采用冷却结晶法从乙的饱和溶液中可得到晶体乙
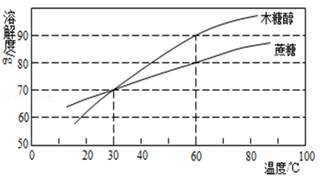
木糖醇是一种理想的蔗糖替代品,其甜度相当于蔗糖。如下左图是木糖醇和蔗糖的溶解度曲线:
-
(1) 20℃时,木糖醇的溶解度(填:大于、等于、小于)蔗糖的溶解度。
-
(2) 60℃时,100g水中加入60g木糖醇,充分溶解后,所得溶液为(填饱和或不饱和)溶液。
某温度时,将100克A物质的溶液分成两等份,将其中一份溶液蒸发掉5克水后,降至原温度,溶液刚好达到饱和:温度不变,在另一份溶液中加入1.2克A物质(该物质不含结晶水),完全溶解并达到饱和,则A物质在该温度下的溶解度为( )
A . 1.2
B . 2.4克
C . 24
D . 24克
烧杯①中溶液是60℃时含有120g水的NH4Cl溶液,经过下图操作后得到18.0gNH4Cl固体,已知60℃和20℃时,NH4Cl的溶解度分别为55.2g和37.2g,下列说法正确的是( )
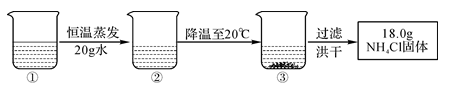
A . ②中溶液和③中溶液分别为60℃和20℃时NH4Cl的饱和溶液
B . ①中溶液和②中溶液均为60℃时NH4Cl的不饱和溶液
C . ①中溶液的溶质质量大于②中溶液的溶质质量
D . ②中溶液和③中溶液的溶质质量分数相等
硝酸钾和氢氧化钙在工农业上有广泛应用,其溶解度如表所示,下列说法正确的是( )
| 温度(℃) | 0 | 20 | 40 | 60 | 80 |
| 硝酸钾溶解度(克) | 13.3 | 31.6 | 63.9 | 110 | 169 |
| 氢氧化钙溶解度(克) | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
A . 两种物质的溶解度都随温度升高而增大
B . 20℃时的氢氧化钙饱和溶液降温至10℃,溶质质量分数增大
C . 60℃时100g、110g、120g硝酸钾分别放入100g水中,溶质质量分数依次增大
D . 80℃时100g饱和硝酸钾溶液中,溶质和溶剂的质量比为169:100
硝酸钾和氯化钾的溶解度曲线如图所示:
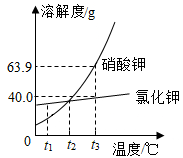
-
(1) t3 ℃时,氯化钾的溶解度为g。
-
(2) 将t3 ℃时硝酸钾的饱和溶液163.9 g稀释成质量分数为20.0%的硝酸钾溶液,需加水g。
-
(3) 现有t3 ℃时硝酸钾的饱和溶液m1 g和氯化钾的饱和溶液m2 g。不考虑水的蒸发,下列说法正确的是 (填字母标号)。A . t3 ℃时硝酸钾的饱和溶液比氯化钾饱和溶液溶质的质量分数大 B . 分别降温到t2 ℃,两溶液中溶质的质量分数相等 C . 分别降温到t2 ℃,氯化钾饱和溶液析出的溶质更多 D . 不同温度下,硝酸钾溶解度可能大于、小于或等于氯化钾的溶解度
图为甲、乙(均不含结晶水)两种固体物质在水中的溶解度曲线。
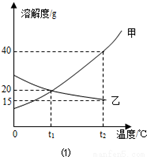
-
(1) t1℃时,甲的溶解度乙的溶解度(填“大于”或“小于”或“等于”)。
-
(2) t2℃时,40g水中溶解g乙物质恰好达到饱和。
-
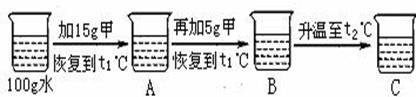
(3) 某同学在t1℃时开始如下实验,得到相应的溶液A、B、C。在溶液A、B、C中,属于饱和溶液的是;在溶液C中再加入25g甲后,充分搅拌,恢复到t2℃,所得溶液的质量为。
下列有关氯化钠(NaCl)溶解度的说法,正确的是( )
A . 20℃时,18.0gNaCl溶解在50g水中达到饱和状态,故20℃时,NaCl的溶解度为18.0g
B . 36.0g NaCl溶解在100g水中达到饱和状态,NaCl的溶解度为36.0g
C . 20℃时,36.0gNaCl溶解在100g水中,故20℃时,NaCl的溶解度为36.0g
D . 20℃时,100g水中最多能溶解36.0gNaCl,故20℃时,NaCl的溶解度为36.0g
最近更新



