固体溶解度的概念 知识点题库
20℃时32g NaCl固体能完全溶解在100g水中,则20℃时NaCl的溶液度为32g.这句话是否正确?说明理由.
20℃硝酸钾饱和溶液恒温蒸发掉16g水,析出4g硝酸钾,则20℃硝酸钾饱和溶液( )
A . 溶质的质量分数是16%
B . 溶质的质量分数是25%
C . 硝酸钾的溶解度40g
D . 硝酸钾的溶解度25g
在一定温度下,某固态物质在中达到状态所溶解的质量,叫做这种物质在这种溶剂中的溶解度.影响固体物质溶解度大小的内因是,外因.
甲、乙两同学在室温下各取100克某溶液分别做制晶体实验,甲将溶液蒸发掉20克水后冷却至室温得晶体2.4克(晶体不含结晶水),乙将溶液蒸发掉30克水后冷却至室温,得晶体4.8克。若两人实验结果都正确,则原100克某溶液中溶质的质量分数为( )
A . 1.1%
B . 17.4%
C . 22.2%
D . 36.1%
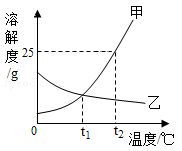
请根据如图中甲、乙两种物质的溶解度曲线,回答下列问题.

-
(1) 在℃时,甲、乙两种物质的溶解度相同.
-
(2) t2℃时,100g水中溶解g甲物质恰好达到饱和,该饱和溶液中溶质的质量分数为.
-
(3) 临近海边的人常常“夏天晒盐,冬天捞碱”,图中与“碱”的溶解度曲线相似的是.
如图是某实验小组的同学绘制的两种固体物质的溶解度曲线图。请你根据图示回答问题:

-
(1) t1℃时,a 物质的溶解度b 物质的溶解度(填“>”、“<”或“=”)。
-
(2) 将 t2℃时 a、b 两种物质相同质量的饱和溶液,分别冷却到 t1℃,析出晶体最多的是物质。
-
(3) 溶解度曲线图中的任何一点都表示溶液的一种特定状态。图中A、B 两个状态中,溶液属于不饱和状态的是。
某温度时,将100克A物质的溶液分成两等份,将其中一份溶液蒸发掉5克水后,降至原温度,溶液刚好达到饱和;温度不变,在另一份溶液中加入1.2克A物质(该物质不含结晶水),完全溶解并达到饱和,则A物质在该温度下的溶解度为.
向盛有40克硝酸钾的烧杯中加入60克水,充分溶解后现象如图所示,此时溶液温度为30℃。下列说法正确的是( )

A . 烧杯中溶液总质量为100克,溶液的溶质质量分数为40%
B . 烧杯中溶液为30℃时硝酸钾饱和溶液,且30℃时硝酸钾的溶解度为40克
C . 若使烧杯中的固体全部溶解,则溶液的溶质质量分数一定增大
D . 若使烧杯中的溶液变为不饱和溶液,则溶液的溶质质量分数可能增大
30℃时将等质量的两份饱和石灰水一份冷却到20℃,另一份加入少量生石灰,温度仍保持在30℃。则两种情况下均不改变的是( )
A . 溶剂的质量
B . 溶质的质量
C . 溶质的溶解度
D . 溶液中溶质的质量分数
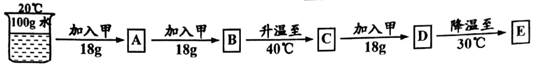
下表是甲物质在不同温度时溶解度按下图步骤进行操作:
|
温度/℃ |
10 |
20 |
30 |
40 |
|
溶解度/g |
10.0 |
18.0 |
36.0 |
56.0 |
-
(1) 在A一E的溶液中,溶质质量分数最大的是(填字母)。
-
(2) 要使E中未溶的甲物质全部溶解,至少需要加入30℃的水克。
我国有许多盐碱湖,湖水中溶有大量的氯化钠和纯碱,那里的人们冬天捞碱、夏天晒盐。下表是氯化钠、纯碱在不同温度下的溶解度,请结合内容回答下列问题。
|
温度/℃ |
0 |
10 |
20 |
40 |
60 |
80 |
|
|
溶解 度/g |
氯化钠 |
35.7 |
35.8 |
36.0 |
36.6 |
37.3 |
38.4 |
|
纯碱 |
7.1 |
12.5 |
21.5 |
38.8 |
46.0 |
43.9 |
|
-
(1) 由溶解表可知,氯化钠与纯碱的溶解度恰好相等时的温度范围是_____________A . 0℃~10℃ B . 10℃~20℃ C . 20℃~ 40℃ D . 40℃~60℃
-
(2) 长期在液面以外的咸菜表面会出现白色晶体,这晶体的形成与(填“冬天捞碱”或“夏天晒盐”)的原理一致。
-
(3) 生活中纯碱既可用于洗衣又能发面。现要配制纯碱溶液,取48克纯碱溶于100克60℃的水中,所得溶液的溶质质量分数为多少(保留一位小数)?
如图是A、B两物质的溶解度曲线,下列信息中正确的是( )
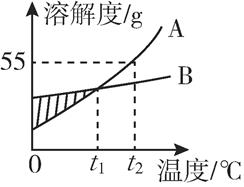
A . 图中阴影部分表明A,B两溶液都是饱和溶液
B . t1℃时,A,B两饱和溶液的溶质质量分数相等
C . t2℃时,B物质的溶解度大于A物质的溶解度
D . t2℃时,等质量的A,B两饱和溶液降温到t1℃时析出溶质的质量相等
如图甲是A、B、C三种物质的溶解度曲线图。如图乙烧杯中的某饱和溶液的溶质为A、B、C三种物质中的一种,已知生石灰与水反应会放出热量。下列说法正确的是( )
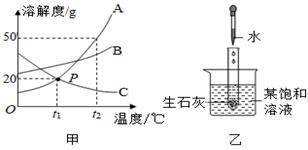
A . 三种物质的溶解度大小关系为A>B>C
B . 在t2 ℃时,30 g A加入到50 g水中形成80 g溶液
C . 将t2 ℃下A,B,C的饱和溶液降温到t1 ℃,所得溶液中溶质质量分数大小关系为B>A=C
D . 生石灰与水反应完全后,如图乙烧杯中的饱和溶液变浑浊,说明该饱和溶液的溶质是C
如图为A、B、C三种固体物质(不含结晶水)的溶解度曲线。下列说法错误的是( )
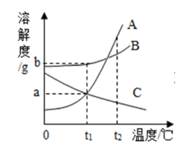
A .  时,三种物质中B的溶解度最大
B .
时,三种物质中B的溶解度最大
B .  时,取三种物质各a克分别放入100g水中充分溶解,只有C物质能形成饱和溶液
C . 将等质量的三种物质的饱和溶液分别由
时,取三种物质各a克分别放入100g水中充分溶解,只有C物质能形成饱和溶液
C . 将等质量的三种物质的饱和溶液分别由  降温到
降温到  ,B溶液中析出的晶体质量最小
D . 可用降温的方法使接近饱和的B溶液变为饱和溶液
,B溶液中析出的晶体质量最小
D . 可用降温的方法使接近饱和的B溶液变为饱和溶液
 时,三种物质中B的溶解度最大
B .
时,三种物质中B的溶解度最大
B .  时,取三种物质各a克分别放入100g水中充分溶解,只有C物质能形成饱和溶液
C . 将等质量的三种物质的饱和溶液分别由
时,取三种物质各a克分别放入100g水中充分溶解,只有C物质能形成饱和溶液
C . 将等质量的三种物质的饱和溶液分别由  降温到
降温到  ,B溶液中析出的晶体质量最小
D . 可用降温的方法使接近饱和的B溶液变为饱和溶液
,B溶液中析出的晶体质量最小
D . 可用降温的方法使接近饱和的B溶液变为饱和溶液
为了探究气体的溶解性与哪些因素有关,某科学兴趣小组设计了如下实验进行探究:
【实验步骤】先将氧气溶解在水中,记录数据至表格。
|
因素 |
温度 |
外界气压 |
溶解度 |
|
第一组 |
0 ℃ |
101 千帕 |
0.18 g |
|
第二组 |
20 ℃ |
101 千帕 |
0.16 g |
|
第三组 |
50 ℃ |
101 千帕 |
0.12 g |
|
第四组 |
0 ℃ |
200 千帕 |
0.3 g |
|
第五组 |
20 ℃ |
200 千帕 |
0.27 g |
【实验分析】试回答:
①比较第一、二、三和第一、四(或二、五)组可以得出结论:。
②由上图表格可以推算出,在标准大气压下,10 dm3 的冰刚刚融化成水(正好 0 ℃) 里面含有的氧气。【已知冰的密度为 0.9 g/cm3 , 水的密度为 1 g/cm3】
【实验改进】请指出并改正该实验存在的问题:。
如图是甲、乙两物质的溶解度曲线.由溶解度曲线得出以下几条信息,正 确的是( )

A . 甲物质的溶解度大于乙物质的溶解度
B . t1℃时,甲和乙的水溶液中溶质质量分数一定相等
C . t2℃时把 30 克甲溶解在 100 克水中,所得溶液为饱和溶液
D . t1℃甲乙恰好形成的饱和溶液,当升温到 t2℃时甲乙溶质质量分数相等
下表是硝酸钾(KNO3)和氯化钾(KCl)在不同温度时的溶解度,请回答:
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
|
溶解度/g |
KNO3 |
13.3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
|
KCl |
27.6 |
31.0 |
34.0 |
37.0 |
40.0 |
42.6 |
45.5 |
48.3 |
|

-
(1) 由表可查知,40℃时氯化钾(KCl)的溶解度为40克,它的意义是。
-
(2) 40℃时,向两个分别盛有45g硝酸钾和氯化钾固体的烧杯中,各加入100g的水,充分溶解后,结果如图所示,则乙烧杯中的溶质是;甲烧杯中溶液的溶质质量分数为。
甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是( )

A . 当甲中含有少量乙杂质时,可以用将混合物在较高温度配制饱和溶液,冷却后析出甲晶体的办法得到纯甲晶体
B . 将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大
C . 将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法
D . t1℃时,甲和乙的饱和溶液各100g,其溶质的质量不相等
如图是 a、b、c 三种物质的溶解度曲线,下列说法不正确的是( )
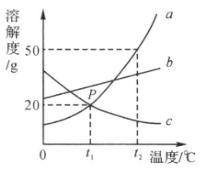
A . P点表示t1℃时,a、c两种物质的溶解度相等
B . 将c的饱和溶液变为不饱和溶液,可采用降温的方法
C . t2℃时,将30ga物质加入到50g水中充分搅拌,得到75ga的饱和溶液
D . 将t1℃时a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是a>b>c
已知:氯化钠和硝酸钾在不同温度下的溶解度如下表。据表回答下列问题。
|
温度 |
10 ℃ |
20 ℃ |
30 ℃ |
40 ℃ |
50 ℃ |
60 ℃ |
70 ℃ |
80 ℃ |
|
氯化钠溶解度/g |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
37.8 |
38.4 |
|
硝酸钾溶解度/g |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
169 |
-
(1) 20 ℃时,将100 g氯化钠加入200 g水中,所得溶液的溶质与溶剂的质量比为(填最简整数比)。
-
(2) 氯化钠中含有少量硝酸钾,要得到比较纯净的氯化钠,可以采用的方法是。
-
(3) 20 ℃时将含有不溶性杂质的硝酸钾加入一定量的水中,充分搅拌后仍有100 g固体没有溶解。继续升高温度至60 ℃,充分搅拌后仍有60.8 g固体没有溶解。然后将混合物升温至80 ℃,再充分搅拌,恒温过滤,得到滤渣34.74 g则这一定量水的质量是g,原固体混合物中硝酸钾的质量分数为。
最近更新



