氧气的工业制法 知识点题库
(1)嫦娥三号的着陆器以液氢、液氧做推进剂.工业上制取氧气、氢气方法有:
①分离液态空气法制氧气:是利用空气中各成分的不同进行分离的;
②水电解法制氢气:可在水电解器的两极上分别制得氢气和氧气,氢气在与电源极相连的电极上产生;
③水煤气法制氢气:用焦炭(主要成分是碳单质)为原料与水蒸气在高温时反应制得H2和CO2 . 反应的化学方程式为 ,这个反应中发生还原反应的物质是 ;
④氢能是理想的能源,但从上述两种制法看,还不能广泛使用的原因是 .
(2)“嫦娥”和“玉兔”的“身体”表面覆盖着用有机材料聚酰亚胺加入金或银制成的薄膜,具有极好的隔热性能,加入金或银的聚酰亚胺薄膜属于材料.
(3)“玉兔”在月球岩石中发现了铁橄榄石(主要成分是Fe2SiO4),还在月球物质中捕获到来自太阳风的Ar﹣36、Ar﹣38.
①铁橄榄石中铁元素的化合价是 .
②Ar﹣36与Ar﹣38在原子构成微粒上的不同点是 .
(1)由于液态氮的沸点比液态氧的沸点 (填“高”或“低”),导致 先从液态空气蒸发出来.
(2)过一会儿小木条燃烧更旺的原因是 .
-
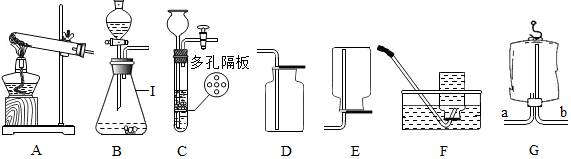
(1) 写出编号I仪器的名称:。
-
(2) 实验室既可以制取CO2 , 又可以制取O2并能控制反应速率的发生装置为(填装置编号),实验室制取CO2的化学方程式为;
-
(3) 某同学利用空塑料输液袋收集二氧化碳(如图G),验满时,把燃着的木条放在玻璃管(填“a”或“b”)端,如果熄灭则满了。
-
(4) 实验室如果用过氧化氢制取较纯净的氧气时,收集装置应选用;药品用(A.6%的过氧化氢溶液 B.20%的过氧化氢溶液)比较合适。
-
(5) 工业制氧气,利用的原料是空气。步骤:首先将空气净化,除去二氧化碳和水蒸气,然后在低温下加压使空气液化,利用氮气和氧气的不同分离出氧气。

-
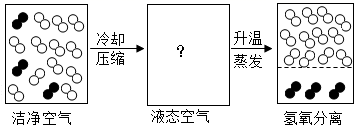
(1) “分离液态空气法”发生的是(填“物理”或“化学”)变化。
-
(2) “
 ”表示的微粒是。
”表示的微粒是。
-
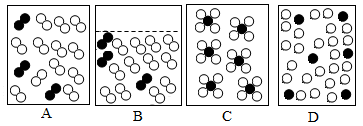
(3) 下列能表示液态空气微观示意图的是。
-
(4) 下列关于“分离液态空气法”制氧气的说法中:①洁净空气是纯净物;②此方法制氧气的原料来源广泛;③液氧比液氮沸点高;④此方法既可得到氧气又可得到氮气。正确的是 (填序号)。
-
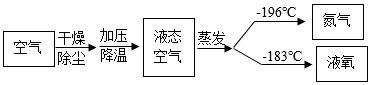
(1) 将燃着的木条置于盛满液态空气的烧杯口,观察到的现象是;
-
(2) 从变化本质区别角度分析,该变化属于(选填“化学变化”或“物理变化”)。
-
(1) 实验室用如图所示的装置制取少量氧气。
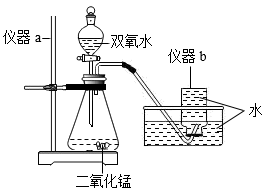
①仪器b的名称是。
②锥形瓶内发生反应的化学方程式是。
-
(2) 工业上有多种制取氧气的方法,如:
方法一:在低温、加压条件下,将空气液化。然后将温度升高至﹣196℃~﹣183℃之间,使液态氮气先蒸发,剩余液态氧气储存于钢瓶里。
方法二:利用电解水的方法制取氧气,将得到的氧气干燥。在低温,加压条件下,使之转化为液态,储存于钢瓶里。
①从构成物质视角分析,方法一空气液化过程中,发生的是变化(填物理或化学)。
②某工厂用方法二制取氧气,所得液氧中常有淡淡的鱼腥气味的臭氧(O3)。从微观角度分析,氧气和臭氧的化学性质不同的原因是。
-
(3) 氢气和氧气在Pd基催化剂表面可反应生成H2O2 , 微观示意图如图所示。
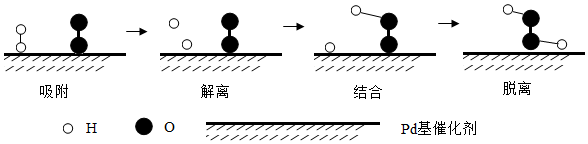
“解离”时,结构被破坏的分子是(填化学式)。
-
(4) 为探究双氧水的分解,进行以下两个实验:
①氯化物对双氧水分解的影响。
反应条件:6.0mL30%双氧水,0.1g氯化物,室温;实验时间:1.5h。
实验数据如表所示:
氯化物
NaCl
MgCl2
CuCl2
放出氧气的体积/mL
2.0
4.0
420.0
双氧水的分解率/%
0.30
0.60
63.18
由上表可知,双氧水保存时应绝对避免引入的离子是(写离子符号)。
②pH对双氧水分解的影响。
反应条件:6.0mL30%双氧水,60℃;用NaOH 溶液调pH;
实验时间:1.5h。
实验结果如图所示:
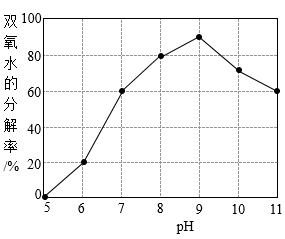
由图可知,pH为(填数字)时,双氧水的分解率最高。
-
(5) 用双氧水可制得“鱼浮灵”、“钙多宝”。
①”鱼浮灵”主要成分是 2Na2CO3•3H2O2 , 可迅速增加水体含氧量,其原因是。
②”钙多宝”主要成分是CaO2 , 常温下能与水反应生成氢氧化钙和氧气。长时间存放的过氧化钙中含有主要杂质是Ca(OH)2、(填化学式)。



