燃烧的条件与灭火原理探究 知识点题库
“纸火锅”(如图)是用纸张代替金属材料做容器盛放汤料,当酒精燃烧时纸张不会燃烧。对此现象,下列解释合理的是( )
探究实验
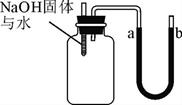
二氧化碳的溶解性实验 氢氧化钠溶解于水
A B
-
(1) 探究物质性质:上述A、B两个实验都是通过 的变化来间接感知。B实验中 (填a或b)处的水位升高的。
-
(2)
探究可燃物燃烧条件
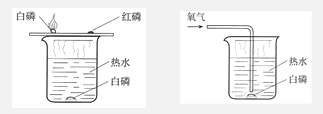
探究燃烧的条件
实验中探究可燃物的燃烧条件,它是通过控制可燃物是否与氧气接触和控制 来探究可燃物燃烧的条件。能证明燃烧必须与氧气接触的实验现象是 ;采用了 的实验手段。 -
(3)
物质性质的应用:
实验序号 实验目的 实验方案 实验现象 结论
实验1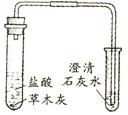
草木灰的主要成分是碳酸钾
做完“铁在氧气中燃烧”实验后,小冬同学有两个疑惑不解的问题,于是她进行了以下探究活动,请你一同参与。
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1]
(1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸溶液。
[实验探究]
将冷却后的黑色物质碾碎,装入试管,加入 溶液,观察到的现象是 ,说明铁燃烧时溅落下来的黑色物质中还含有铁。
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见右表: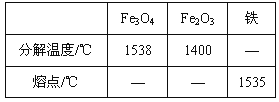
(2)Fe2O3高温时分解成Fe3O4。
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在 之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是Fe3O4。
[拓展延伸]
(1)实验中为了防止集气瓶炸裂,必须 ;
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式 ;
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色变为 ,就说明包装盒破损进气,这样售货员就能及时发现并处理。
下面是两个探究可燃物燃烧条件的实验,请回答相关问题。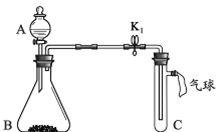
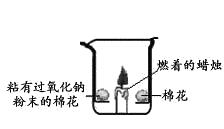
图 1 图 2
(1)如图1向C中加入少量白磷,再加入热水,塞好胶塞,使导管口浸入热水中,白磷不燃烧。打开K1 , 将A中溶液滴入B中,C中有气泡冒出,白磷燃烧。C中发生反应的化学方程式为 。此实验运用对比的方法研究了燃烧的一个条件,它是 。
(2)如图2所示,在空气中放置时,两团棉花均不燃烧;若将足量二氧化碳倒入烧杯时,可以观察到的现象有:① ;②粘有过氧化钠的棉花燃烧;③未粘有过氧化钠的棉花不燃烧。通过上述实验的对比分析,写出产生现象②的原因 。
某化学学习小组利用如图设计方案来探究可燃物燃烧的条件.
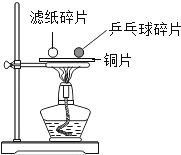
-
(1) 此实验主要利用了铜的什么物理性质?
-
(2) 按如图进行实验,可得出的实验结论是什么?
-
(3) 实验后小亮发现铜片变黑了,质量也变大了.请解释原因.
已知:白磷的着火点为40℃
内容 装置 | (实验1) 探究可燃物燃烧条件 | (实验2) 探究氢氧化钠性质 |
| I. A中盛有H2O2溶液,B中盛有MnO2 , C中盛有80℃的热水和一小块白磷 | I. A中盛有滴有酚酞的 NaOH溶液,B中充满CO2 , C中盛有稀硫酸 |
II. 打开分液漏斗活塞,将A中溶液滴加到B中,关闭分液漏斗活塞并打开K | II. 打开分液漏斗活塞,将A中溶液滴加到B中,关闭分液漏斗活塞。充分反应后,打开K |
-
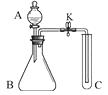
(1) H2O2溶液与MnO2接触时,发生反应的化学方程式为。
-
(2) 实验1中,打开K后观察到C中白磷燃烧。该实验证明可燃物燃烧的条件之一是。
-
(3) 实验2中,对于所观察到的以下三个实验现象:C中部分液体沿导管流入B中,B中有气泡生成,B中溶液由红色变为无色。解释产生上述现象的主要原因(用化学方程式表示)。
-
(1) 救火难度大:①以橡木为主要材料的高耸屋顶框架为燃烧提供一个条件是:,这是救火最大困难所在;②直升机无法在热空气中投水灭火。一般来说,热空气中氧气的体积分数21%(填“>”“=”或“<”)。
-
(2) 火灾的警示:文物保护意识应警钟长鸣,并构建安全保护机制。机制内容之一可在可燃建筑材料中加入阻燃剂,而Mg(OH)2是一种常见的阻燃剂,在380℃时分解成水蒸气和耐高温的MgO,并吸收大量的热。
①写出Mg(OH)2阻燃时发生反应的化学方程式:;
②写出Mg(OH)2阻燃的一个原因:。
-
(1) 小明用木柴烧火时,发现木柴燃烧不旺,产生很多浓烟,于是他把木柴架高,这是为了,使燃烧更旺。
-
(2) 野炊中,小明取河水进行加热煮沸,从化学视角来看,这样既可以消毒杀菌,又可以。
-
(3) 野炊结束时,妈妈用水把火浇灭,其原理是。
-
(4) 路过村庄,小红发现村里新建了沼气池。沼气的主要成分是,沼气用做燃料与木柴、煤相比的优点是。走过田间,小红看到一位阿姨正准备把碳酸氢铵和草木灰混合使用,她马上制止,其原因是。
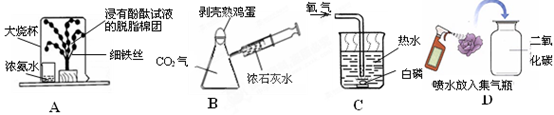
-
(1) 图A所示实验可观察到“铁树”上浸有无色酚酞试液的棉团由白色变为色,该实验中没有涉及的性质是(填字母)。
A氨分子是不断运动的 B氨分子有一定质量 C浓氨水具有挥发性
-
(2) 图B所示实验,将注射器中浓石灰水注入瓶中,会看到鸡蛋被“吞”入瓶中,该实验中涉及的化学方程式为。
-
(3) 图C所示实验,当通过导管向热水中通入氧气时,白磷在水下燃烧,该实验说明燃烧需要的条件为:①可燃物;②达到燃烧所需要的;③,反应的化学方程式为。
-
(4) 图D所示实验观察到紫色小花变为红色,小花变红的原因是(用化学方程式表示)。
-
(1) 烧烤时远远就能闻到诱人的香味,从微观角度解释其原因是什么?
-
(2) 烧烤时常用木炭作燃料,木炭不完全燃烧会产生大气污染物,若想让木炭充分燃烧,可采用的具体措施是什么?(写出一条即可)
-
(3) 烧烤过后可用水浇灭木炭,其灭火原理是什么?
-
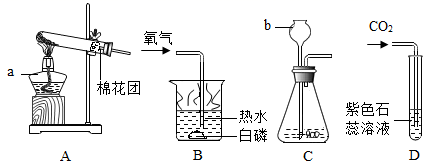
(1) 写出图中所示实验仪器的名称:a;b;
-
(2) 连接 A,B 装置,观察到 B 装置热水中的白磷燃烧,由白磷燃烧的事实说明燃烧需要的条件之一是。
-
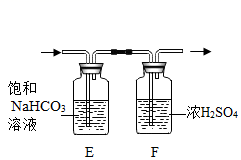
(3) 王刚同学利用C,D装置进行二氧化碳的实验制取、性质实验,C 中反应所需药品是;D 中实验现象是。李静同学利用图中E、F装置得到纯净、干燥的二氧化碳气体,E中饱和NaHCO3溶液的作用是 。

-
(1) 用图1中A装置制取氧气,发生反应的化学方程式是;试管口塞一团棉花的作用是。
-
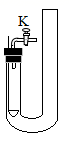
(2) 图1中A装置导管与图2中U形管导管口连接后打开弹簧夹,然后将U形管放人大烧杯中,观察到的现象是。
-
(3) 图1中用C装置制取二氧化碳与B装置相比优点是;从图中选择二氧化碳收集装置的依据是 。
(提出问题)足量红磷在密闭的四颈平底烧瓶内燃烧熄灭后,容器中是否有氧气剩余?
(猜想假设)猜想①:有氧气剩余 猜想②:无氧气剩余
(查阅资料)燃烧需要与氧气接触
(实验验证)该小组同学按图1组装好实验装置,利用高能激光笔照射燃烧匙上的红磷,红磷燃烧直至熄灭;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷居然也被点燃。
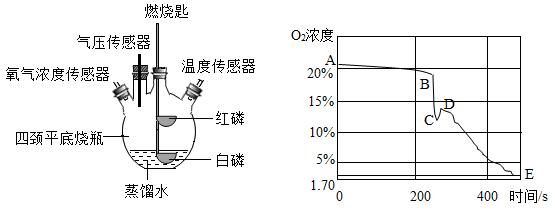
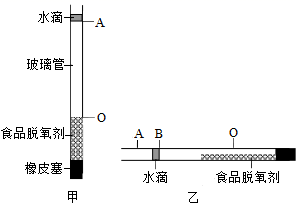
图2是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用氧气传感器测量容器内氧气浓度变化的曲线图。
-
(1) 红磷燃烧的表达式。
-
(2) 实验开始时用激光笔照射,水上的红磷能够燃烧,而水下的白磷不会燃烧的原因是。在图2中(填“A、B、C、D、E”)点时红磷燃烧熄灭。
-
(3) 结论:猜想正确,因此用燃烧法测定空气中氧气含量”时,选择(填“红磷”或“白磷”)更合适,理由是。
-
(4) (拓展延伸)为提高测定空气中氧气含量实验的精确度,45中化学兴趣小组又对实验进行了创新改进。
①取一根玻璃管用橡皮塞将一端密封;
②将食品脱氧剂粉末迅速装入玻璃管,立即向管口注入一滴水将玻璃管密封,水滴的下端标 为A。弹动玻璃管使脱氧剂粉末分布均匀且紧密,脱氧剂的上端标为O,如图甲所示:
③水平滚动玻璃管,使食品脱氧剂粉末平铺在玻璃管中,静置至水滴不再移动时,水滴的右端标为B,如图乙所示;
④测量出AO段和AB段的长度,并计算出AB和AO的比值,将数据记录在表格中。
实验次数
AO/mm
AB/mm
AB/AO
1
523.5
109.5
0.2092
2
525.5
110.0
0.2093
3
527.0
110.5
0.2097
根据表格中的实验数据,可知空气中氧气含量为。(用百分数表示)
-
(5) 实验步骤③中,将食品脱氧剂粉末平铺在玻璃管中的目的是。
-
(6) 实验步骤②中,如果玻璃管内的脱氧剂粉末分布不够紧密,会使实验结果偏大,其原因是。
|
实验装置 |
实验1 探究燃烧的条件 |
实验2制取二氧化碳 |
|
| Ⅰ.燃烧匙中放置一小块白磷(着火点为40℃),装置中盛放80℃的热水(浸没白磷)。 Ⅱ.打开K,从导管口鼓入空气至白磷露出水面,关闭K。 | Ⅰ.燃烧匙中盛有大理石,装置中盛放一定量的稀盐酸(浸没大理石)。 Ⅱ.打开K,收集二氧化碳。Ⅲ.…… |
-
(1) 实验1中,能证明燃烧需要与氧气接触的实验现象是 ;
-
(2) 实验2中,制取二氧化碳的化学方程式为;
-
(3) 实验2中,为使反应停止,Ⅲ中的操作是。
-
(1) (提出问题)。
-
(2) (猜想与假设)①超氧化钾和水反应生成。②。
-
(3) (设计与实施)为了验证猜想,有同学提出如下实验方案:向盛有KO2的试管中滴加适量水,若看到有气泡产生,证明猜想1成立。在上述实验的试管口拴上一个气球,若气球变鼓,证明猜想2成立。你是否同意该实验方案,你的理由是。
在老师的指导下,同学们又进一步完善该方案并用下图所示装置进行实验验证。
实验装置
实验目的
实验操作及现象
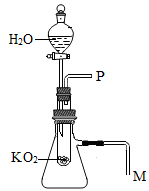
验证猜想1
将带火星的木条放在处,发现木条复燃。
验证猜想2
(实验结论)超氧化钾与水发生的化学反应,满足了棉花燃烧的条件。
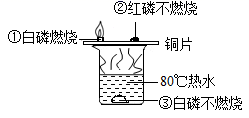
资料信息:白磷和红磷的着火点分别是40℃、240℃。
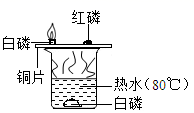
-
(1) 实验中,铜片上的红磷不燃烧,是因为。
-
(2) 水中的白磷不燃烧,是因为,如果要让水中的白磷在水下燃烧,应采取的措施是。
-
(3) 烧杯中的水在实验中的作用是。
A、 作反应物 B、 隔绝空气 C 、升高温度
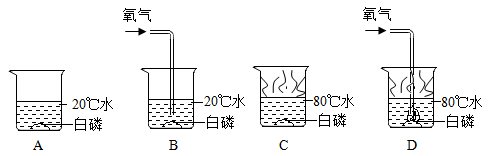
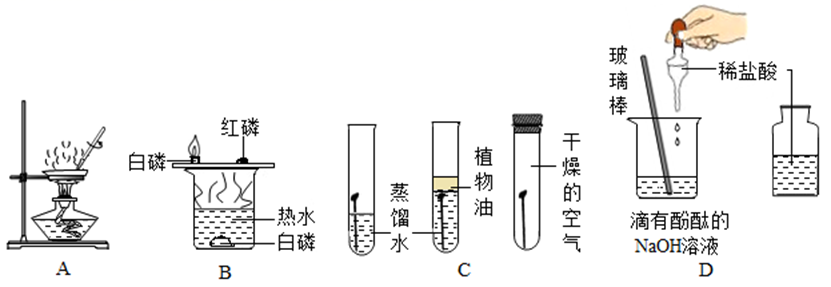
-
(1) A图所示的实验中,玻璃棒的作用。
-
(2) B图所示的实验中,由铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明燃烧需要;烧杯中热水的作用。(答出一点即可)
-
(3) 通过C图所示的实验,可以得出铁制品锈蚀的条件为:铁与反应。
-
(4) D图所示的实验中,加入酚酞的作用是;实验中逐滴加入稀盐酸的目的是。
-
(1) 实验一:利用表中装置进行实验。
已知:集气瓶容积为350mL,集气瓶中水为100mL。
装置
实验
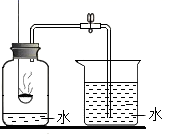
集气瓶中盛有用排空气法收集的氧气,燃烧匙中为足量红磷
I.关闭止水夹,点燃红磷迅速塞紧胶塞
Ⅱ.待冷却后,打开止水夹,当烧杯中液面不再变化时,测得烧杯中减少了200mL水。
加入足量红磷的目的是。
-
(2) 集气瓶中,O2的体积分数约为%。
-
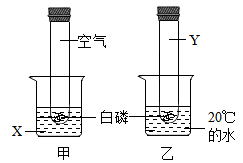
(3) 实验二:按如图所示方案进行“探究燃烧条件之一是温度要达到可燃物的着火点”的实验(已知:白磷的着火点是40℃),观察到:
甲中白磷燃烧,乙中白磷不燃烧。甲中的X、乙中的Y分别为、。