物质的量的相关计算 知识点题库
在无土栽培中,需配制一定组成的植物营养液.已知某植物营养液的配方为0.6mol KCl、0.4mol K2SO4、0.20mol ZnSO4和1LH2O.若以KCl、K2SO4、ZnCl2和1LH2O为原料配得相同组成的营养液,需三种溶质的物质的量为( )
A . 0.20 mol、0.60 mol、0.20mol
B . 0.30 mol、0.60 mol、0.10 mol
C . 0.40 mol、0.60 mol、0.10 mol
D . 0.20 mol、0.10mol、0.60 mol
根据题意填空
-
(1) 已知16克A和20克B恰好完全反应生成0.05mol C和30克D,则C的摩尔质量为
-
(2) 0.3mol氨气和0.4mol二氧化碳的质量(填“相等”或“不相等”,下同),所含原子数.
-
(3) 4g H2与22.4L(标准状况)CO2相比,所含分子数目较多的是.
-
(4) 3.01×1023个CO2分子中含 mol氧原子,在标准状况下其体积为 L,它与 g H2O含有相同的氧原子数.
-
(5) 写出下列物质的电离方程式:硫酸铵;氢氧化钡.
标准状况下,同体积的下列物质中所含有的分子数最多的是( )
A . CO2
B . H2
C . H2O
D . O2
每年10月23日上午6:02到晚上6:02被誉为“摩尔日"(Mole Day),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数6.02×1023相似。用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A . 标准状况下,22.4L CCl4含有NA个CCl4分子
B . 1mol/L Mg(NO3)2溶液中含有NO3﹣的数目为2NA
C . 等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度也相等
D . 5.6g铁与足量盐酸反应转移的电子数为0.2NA
某元素原子的质量数为A,它的离子Xn+核外有y个电子,Wg这种原子的原子核内中子的物质的量为( )
A . 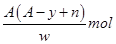 B .
B . 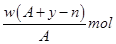 C .
C . 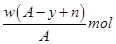 D .
D . 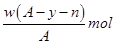
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A . 标准状况下22.4LCO2与足量的Na2O2反应转移电子数为2NA
B . 标准状况下,11.2L H2O含有的分子数为0.5NA
C . 40g NaOH溶解在1L水中,则其100 mL溶液中含Na+数为0.1NA
D . 25℃,1.01×105 Pa,14g氮气中含有7NA个电子
某氧化变质的亚硫酸钠样品,测得其中含氧量为a%,则含硫量为( )
A . 1-a%
B . 1-  a%
C .
a%
C . 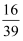 (1-a%)
D . 无法计算
(1-a%)
D . 无法计算
 a%
C .
a%
C . 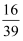 (1-a%)
D . 无法计算
(1-a%)
D . 无法计算
下列物质中含原子数最多的是( )
A . 6.4g O2
B . 8.8g CO2
C . 0.1mol N2
D . 3.01×1022个H2O
设NA表示阿伏加德罗常数,下列说法正确的是( )
A . 1mol氦气中含有2NA个氦原子
B . 14g氮气中含2NA个氮原子
C . 25℃,101 kPa下,64g SO2中含有的原子数为3NA
D . 标准状况下,11.2 L H2O含有的分子数为0.5NA
在标准状况下,由CO和CO2组成的混合气体为6.72L,质量为12g。则:
-
(1) 混合气体的密度是。(结果保留两位小数)
-
(2) CO和CO2的物质的量之比是。
-
(3) CO的体积分数是。
-
(4) 混合气体中所含氧原子的物质的量是。
设NA为阿伏加德罗常数的值,下列说法错误的是( )
A . 将1 mol钠单质与氧气反应分别生成Na2O和Na2O2 , 转移电子数均为NA
B . 标准状况下,将1 mol Cl2通入足量的水中,转移电子数小于NA
C . 标准状况下,2.24 L四氯化碳中含共价键数目为0.4 NA
D . 2 L 0.5 mol·Lˉ1 醋酸钠溶液中含有Na+离子的数目为NA
下列说法正确的是( )
A . Mg的摩尔质量是24 g
B . 摩尔是七个基本物理量之一,符号为mol
C . 在标准状况下,22.4 LH2O的质量约为18 g
D . 9 g H2O与0.5 mol NO2有相同的分子数
在容积相同的三个容器里分别充入三种气体:①氢气 ②二氧化碳 ③氧气,并保持三个容器内气体的温度和密度均相等,下列说法正确的是( )
A . 分子数目:①=②=③
B . 质量关系:①<③<②
C . 压强关系:①>③>②
D . 原子数目:②>③>①
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A . 0.2mol•L-1的MgCl2溶液中含Cl-数目为0.4NA
B . 标准状况下,11.2LH2与11.2LD2所含的质子数均为NA
C . 6.4gCu与3.2g硫粉混合隔绝空气加热,充分反应后,转移电子数为0.2NA
D . 1LpH=1的H2SO4溶液中,含H+数目为0.2NA
用NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
A . 30gHCHO与CH3COOH混合物中含C原子数为NA
B . 4.8g正丁烷和1.0g异丁烷的混合物中共价键数目为1.4NA
C . 273K、 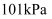 时,2.24LCH3OH完全燃烧消耗O2分子数为0.15NA
D . 0.1 mol·L-1Na2CO3溶液中含有的
时,2.24LCH3OH完全燃烧消耗O2分子数为0.15NA
D . 0.1 mol·L-1Na2CO3溶液中含有的  数目小于0.1 NA
数目小于0.1 NA
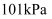 时,2.24LCH3OH完全燃烧消耗O2分子数为0.15NA
D . 0.1 mol·L-1Na2CO3溶液中含有的
时,2.24LCH3OH完全燃烧消耗O2分子数为0.15NA
D . 0.1 mol·L-1Na2CO3溶液中含有的  数目小于0.1 NA
数目小于0.1 NA
设NA为阿伏加德罗常数的值,下列说法中一定正确的是( )
A . 1molFe3O4被完全还原为Fe2+时转移的电子数为2NA
B . 10.5gHClO中含有H—Cl键的数目为0.2NA
C . 2molSO2与1molO2充分反应后气体分子总数小于2NA
D . 8.8g由CO2和N2O组成的混合气体含氧原子总数为0.3NA
纳米铁(直径一般从几纳米到几十纳米)可通过不同反应机制(吸附、还原、催化氧化)去除环境有机、无机污染物,通过番石榴叶提取液还原Fe3+制备纳米铁(Fe0)氧化去除As(Ⅲ)(罗马数字为元素的化合价)的过程如图所示。下列叙述不正确的是( )
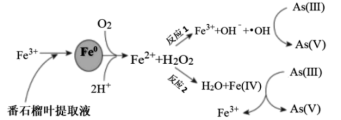
A . 将纳米铁与水形成分散系,可以发生丁达尔效应
B . 反应1的前半程,1 mol H2O2反应转移2 mol电子
C . 反应2中,Fe2+与H2O2的物质的量之比为1:1
D . 若要氧化去除1 mol As(Ⅲ),则至少需要112 g纳米铁
氨基甲酸铵(H2NCOONH4)是一种重要的化工原料,易分解,极易水解。实验室利用下列反应和相关装置制备氨基甲酸铵。2NH3(g) + CO2(g)  H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0
 H2NCOONH4(s) ΔH<0
H2NCOONH4(s) ΔH<0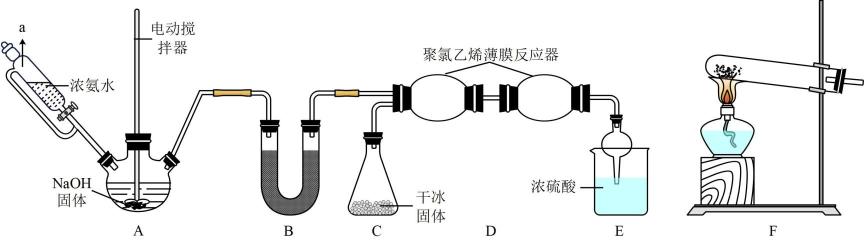
已知:常压下,有关物质的熔沸点:
物质 | CO2 | H2NCOONH4 |
熔点 | - 78.45℃ | 59.61℃ |
沸点 | - 56. 55℃ | 58.76℃ |
请回答:
-
(1) 仪器a的名称为;实验室用A或F装置均可制备氨气,其中F装置的反应方程式是。 装置B内盛放的试剂是。
-
(2) E装置能控制原料气按反应计量系数充分反应,若反应初期观察到E装置内浓硫酸中产生气泡,接下来的具体操作是。此外,装置E还能防倒吸、、。
-
(3) 对比大理石和盐酸反应制CO2 , 该实验利用千冰升华产生CO2气体的优点有____ (填序号)。A.提供-78℃低温环境,避免氨基甲酸铵分解A . 避免了CO2的除杂干燥 B . 增大了反应物氨气的转化率 C . 加快了氨基甲酸铵的生成速率
-
(4) 产品纯度分析:
①称取产品1.845 g [内含杂质(NH4)2CO3·H2O ],用蒸馏水溶解,定容于100 mL容量瓶中。
②移取20.00 mL上述溶液于锥形瓶,加入足量BaCl2溶液。
③向上述溶液加入足量甲醛(HCHO)溶液,放置5 min,再加入20.00 mL 1.000 mol·L-1NaOH溶液。
④向上述溶液滴加1~2滴酚酞,用1.000 mol·L-1HCl标准溶液滴定,实验三次,测得消耗标准溶液11.00mL。
已知: H2NCOONH4+ H2O= (NH4) 2CO3、4NH
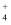 + 6HCHO= [(CH2)6N4H]++ 3H++6H2O、[(CH2)6N4H]+ +OH-= [(CH2)6N4]+ + H2O
+ 6HCHO= [(CH2)6N4H]++ 3H++6H2O、[(CH2)6N4H]+ +OH-= [(CH2)6N4]+ + H2O氨基甲酸铵纯度为 (保留小数点后两位),若无操作②,所测纯度(填“偏大”或“偏小”)。
用 表示阿伏加德罗常数的值,下列叙述错误的是( )
表示阿伏加德罗常数的值,下列叙述错误的是( )
 表示阿伏加德罗常数的值,下列叙述错误的是( )
表示阿伏加德罗常数的值,下列叙述错误的是( )
A . 在标准状况下,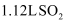 中所含原子总数为
中所含原子总数为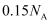 B .
B .  中含有非极性共价键的数目为
中含有非极性共价键的数目为 C .
C .  聚乙烯中含有碳碳双键的数目为
聚乙烯中含有碳碳双键的数目为 D .
D .  苯中含有碳碳双键的数目为
苯中含有碳碳双键的数目为
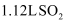 中所含原子总数为
中所含原子总数为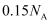 B .
B .  中含有非极性共价键的数目为
中含有非极性共价键的数目为 C .
C .  聚乙烯中含有碳碳双键的数目为
聚乙烯中含有碳碳双键的数目为 D .
D .  苯中含有碳碳双键的数目为
苯中含有碳碳双键的数目为
一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当右边充入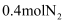 , 左边充入CO和
, 左边充入CO和 的混合气体共12.8g时,隔板处于如图中间位置(左、右两侧温度相同)。则左侧混合气体中碳原子与氧原子的个数比为( )
的混合气体共12.8g时,隔板处于如图中间位置(左、右两侧温度相同)。则左侧混合气体中碳原子与氧原子的个数比为( )
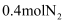 , 左边充入CO和
, 左边充入CO和 的混合气体共12.8g时,隔板处于如图中间位置(左、右两侧温度相同)。则左侧混合气体中碳原子与氧原子的个数比为( )
的混合气体共12.8g时,隔板处于如图中间位置(左、右两侧温度相同)。则左侧混合气体中碳原子与氧原子的个数比为( )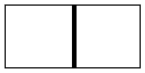
A . 1∶1
B . 3∶1
C . 4∶5
D . 2∶1
最近更新



