物质的量的相关计算 知识点题库
1大气压50℃的条件下,有一氧化碳和二氧化碳两瓶气体,已知它们的质量相等,则两种气体中氧原子的个数之比是 ,两瓶气体的密度之比是
下列说法中正确的是( )
A . 氢氧化钠的摩尔质量是40g
B . 1mol氢氧根离子的质量是17g
C . 1mol氮的质量是14g/mol
D . 氩气的摩尔质量就是它的相对原子质量
根据题意解答
-
(1) 标况下5.6L的CO2质量为 g,其中含有个分子,含有个原子;
-
(2) 现有M、N两种气态化合物,其摩尔质量之比为2:1,试回答下列问题:
①同温同压下,M、N气体的密度之比为.
②相同温度下,在两个相同体积的密闭容器中分别充入M、N,若两个容器中气体的密度相等,则两个容器中的压强之比为.
③将M、N两种气体分别溶于水(M、N与水均不反应)配成溶液,当两种溶液的质量分数相同时,其密度分别为d1和d2 , 则两种溶液的物质的量浓度之比为.
标准状况下,质量相等的下列物质中体积最大的是( )
A . N2
B . Cl2
C . H2
D . CO2
根据要求填空
-
(1) 15.6g Na2X含Na+0.4mol,则Na2X的摩尔质量为 ,X的相对原子质量为
-
(2) 质量分数为36.5%的盐酸密度为1.19g/ml,它的物质的量浓度为
-
(3) 将4g NaOH溶于 g水中,可使溶液中H2O与Na+的物质的量之比为20:1,此溶液中溶质的质量分数为 .
-
(4) 标准状态下,672ml某气体质量为0.84g,该气体摩尔质量为 .
下列物质中含分子数最多的是( )
A . 标准状况下72mL水
B . 80g CO2
C . 标准状况下44.8L氨气
D . 3.01×1023个氢分子
1mol氯化氢中含个氢原子,4.4g二氧化碳与g硫酸所含的分子数相等,它们所含氧原子数之比是.
根据下列物质回答问题:①液态氯化氢 ②二氧化碳③氯化铁溶液 ④稀硫酸 ⑤金刚石,属于电解质的是:(填编号,下同),属于非电解质的是_.
现有14.4gCO和CO2的混合气体,在标准状况下其体积为8.96L.
请回答下列问题:
-
(1) 该混合气体的平均摩尔质量为.
-
(2) 混合气体中碳原子的个数为(用NA表示阿伏加德罗常数的值).
-
(3) 将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定).

①气球收集到的气体的摩尔质量为.
②气球收集到的气体,电子总数为(用NA表示阿伏加德罗常数的值).
③气球的体积为L.
下列条件下,两瓶气体所含原子数一定相等的是()
A . 同质量、不同密度的N2和CO2
B . 同温度、同体积的H2和N2
C . 同体积、同密度的C2H4和C3H6
D . 同压强、同体积的N2O和CO2
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A . 25℃时pH=13的NaOH溶液中含有OH−的数目为0.1NA
B . 标准状况下,22.4L的CCl4中含有CCl4分子数目为NA
C . 25℃时,1L 1mol·L−1的NaClO溶液中含有ClO−的数目为NA
D . 6.4gCu与一定浓度的HNO3完全反应得到混合气体,转移的电子数目为0.2NA
设NA表示阿伏加德罗常数,下列说法正确的是( )
A . 常温常压下,28 g CO和N2的混合气体一定含有2NA个原子
B . 1 L 0.1 mol/L NaHSO4溶液中含有0.1 NA个HSO4-
C . 将0.1 mol FeCl3溶于沸水制成胶体,其中含有的胶体粒子数目为0.1 NA
D . 0.2mol/L KCl溶液中含有0.2 NA个Cl-
如图是硫酸试剂标签上的部分内容,下列说法正确的是( )

A . 该硫酸的物质的量浓度为9.2mol/L
B . 该硫酸中溶剂、溶质分子数目之比为9:2
C . 配置200mL4.6mol/L的稀硫酸,需取该硫酸50mL
D . 该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L
聚合氯化铁[Fe2(OH)nCl6-n]m简称PFC,是一种新型高效的无机高分子净水剂。以FeCl2·4H2O为原料,溶于稀盐酸并加入少量的NaNO2 , 经氧化、水解、聚合等步骤,可制备PFC。
-
(1) 在稀盐酸中,NaNO2会与Fe2+反应生成一种无色气体M,气体M对该反应有催化作用,其催化原理如图所示。 M的化学式为; Fe2+在酸性条件下被O2氧化的离子方程式为。

-
(2) 盐基度[B=
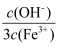 × 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响。(填“越大”、“越小”或“无影响”)
× 100%]是衡量净水剂优劣的一个重要指标。盐基度越小,净水剂对水pH变化的影响。(填“越大”、“越小”或“无影响”)
-
(3) PFC样品中盐基度(B)的测定:
已知:PFC样品的密度ρ = 1.40 g·mL−1 , 样品中铁的质量分数ω(Fe) = 16%
步骤1:准确量取1.00 mL PFC样品置于锥形瓶中。
步骤2:加入一定体积0.05000 mol·L−1的盐酸标准溶液,室温静置后,加入一定体积的氟化钾溶液(与Fe3+反应,消除Fe3+对实验的干扰),滴加数滴酚酞作指示剂,立即用0.05000 mol·L−1氢氧化钠标准溶液滴定至终点,消耗氢氧化钠标准溶液13.00 mL。
步骤3:准确量取1.00 mL蒸馏水样品置于锥形瓶中,重复步骤2操作,消耗氢氧化钠标准溶液49.00 mL。
根据以上实验数据计算PFC样品的盐基度(B)(写出计算过程)。
设NA为阿伏加德罗常数的数值。下列说法正确的是( )
A . 2molSO2和1mol O2混合在催化剂作用下充分反应生成SO3的分子数为2NA
B . 2Fe2++2H++3H2O2=2Fe3++O2↑+4H2O,则每生成1mol O2 , 该反应转移电子数为4NA
C . 25℃时,pH=3的醋酸溶液1L,溶液中含H+的数目小于0.001NA
D . 标准状况下,22.4L苯中C-H数目为6NA
HnRO3中共有x个电子,R原子的质量数为A,则a克HnRO3中含有质子的物质的量为( )
A . 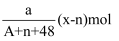 B .
B .  C . (x-n-24)mol
D .
C . (x-n-24)mol
D . 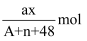
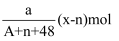 B .
B .  C . (x-n-24)mol
D .
C . (x-n-24)mol
D . 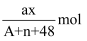
已知标准状况下5.6L的X气体分子的质量为8g,则X气体的摩尔质量是( )
A . 16g
B . 32g
C . 64g/mol
D . 32g/mol
设  为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
 为阿伏加德罗常数的值。下列说法正确的是( )
为阿伏加德罗常数的值。下列说法正确的是( )
A . 7.8g  中的离子总数为0.4
中的离子总数为0.4  B . 1mol
B . 1mol  晶体中含有的共价键为2
晶体中含有的共价键为2  C . 1mol
C . 1mol  (甲基碳正离子)所含质子总数为8
(甲基碳正离子)所含质子总数为8  D . 0.6g
D . 0.6g 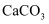 与
与  的混合物中所含质子数为0.3
的混合物中所含质子数为0.3 
 中的离子总数为0.4
中的离子总数为0.4  B . 1mol
B . 1mol  晶体中含有的共价键为2
晶体中含有的共价键为2  C . 1mol
C . 1mol  (甲基碳正离子)所含质子总数为8
(甲基碳正离子)所含质子总数为8  D . 0.6g
D . 0.6g 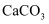 与
与  的混合物中所含质子数为0.3
的混合物中所含质子数为0.3 
标准状况下,11.2L由CO和 组成的混合气体的质量为16g,则下列说法不正确的( )
组成的混合气体的质量为16g,则下列说法不正确的( )
 组成的混合气体的质量为16g,则下列说法不正确的( )
组成的混合气体的质量为16g,则下列说法不正确的( )
A . 混合气体中,CO和CO2的物质的量之比为3:1
B . 混合气体中CO和CO2气体的质量比为21:11
C . 同温同压下,该混合气体的密度是H2密度的16倍
D . 标准状况下,该混合气体中CO2的体积为8.4L
下列各项比较中,相等的是( )
A . 相同物质的量的Na2O和Na2O2所含阴离子数
B . 标准状况下,相同体积的乙炔和苯中所含的氢原子数
C . 相同物质的量浓度的NH4Cl和NH3•H2O溶液中的c(NH )
D . 相同质量的NO和NO2所含氮原子数
)
D . 相同质量的NO和NO2所含氮原子数
 )
D . 相同质量的NO和NO2所含氮原子数
)
D . 相同质量的NO和NO2所含氮原子数
设 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A . 足量的浓盐酸与 反应,转移电子的数目为
反应,转移电子的数目为 B .
B .  重水
重水 中所含质子数为
中所含质子数为 C . 在
C . 在 时,
时, 为12的
为12的 溶液中含有
溶液中含有 数目为
数目为 D .
D . 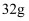 甲醇
甲醇 的分子中含有
的分子中含有 键的数目为
键的数目为
 反应,转移电子的数目为
反应,转移电子的数目为 B .
B .  重水
重水 中所含质子数为
中所含质子数为 C . 在
C . 在 时,
时, 为12的
为12的 溶液中含有
溶液中含有 数目为
数目为 D .
D . 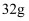 甲醇
甲醇 的分子中含有
的分子中含有 键的数目为
键的数目为
最近更新



