物质的量的相关计算 知识点题库
同温同压下,影响气体体积大小的主要因素是( )
A . 气体分子间平均距离
B . 气体分子数目
C . 气体分子本身的体积
D . 气体相对分子质量
下列各组中两种气体的分子数一定相等的是( )
A . 温度相同、体积相同的O2和N2
B . 质量相等、密度不等的N2和C2H4
C . 体积相同、密度不等的CO和C2H4
D . 压强相同、体积相同的O2和H2
标准状况下,112mL某气体的质量是0.17g,该气体可能是( )
A . O2
B . N2
C . H2S
D . CO2
实验室常用的盐酸是密度1.20g•cm﹣3、质量分数36.5%.
-
(1) 将 L氯化氢(标准状况)通入1.00L水中可得到36.5%的盐酸(保留一位小数).
-
(2) 取10mL36.5%的盐酸,加水稀释至300mL,则稀释后盐酸的物质的量浓度是 mol/L.
-
(3) 向已配制的1mol•L﹣1的NaCl溶液500mL溶液中再通入一定量的HCl气体后,溶液中Cl﹣的物质的量浓度为3mol•L﹣1(假设溶液体积不变),则溶液中H+的物质的量浓度为多少?通入HCl气体的体积(标准状况下)为多少?.
下列叙述不正确的是( )
A . 12.4g Na2R含Na+0.4mol,则Na2R的摩尔质量为62 g/mol
B . 同温、同压、同体积的H2和A2气体的质量分别是0.2g和3.2g,则A的相对原子质量为16
C . 在标准状况下,CO和CO2混合气体共33.6 L,质量为50g,则两种气体的物质的量之比为1:1
D . 浓盐酸的质量分数为36.5%,密度为1.19g•cm﹣3 , 则物质的量浓度是11.9 mol•L﹣1
在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g.此混合气体中CO和CO2物质的量之比为,混合气体的平均相对分子质量是,摩尔质量之比是.
一定量的氢气在氯气中燃烧,所得混合物用100mL 3.00mol/L的NaOH溶液(密度为1.12g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol.
-
(1) 原NaOH溶液的质量分数为.
-
(2) 所得溶液中Cl﹣的物质的量为mol.
-
(3) 所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=.
设NA为阿伏加德罗常数的值,下列叙述一定正确的是( )
A . 2.0gH218O和D2O的混合物中含有质子数为NA
B . 1.0L2.0mol/LNaOH溶液中含有氧原子数为2NA
C . 3.4gH2O2参加氧化还原反应时转移电子数为0.1 NA
D . 标准状况下2.24L的CCl4含有共价键数目为0.4 NA
如果ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是( )
A .  L
B .
L
B . 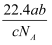 L
C .
L
C . 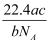 L
D .
L
D . 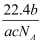 L
L
 L
B .
L
B . 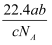 L
C .
L
C . 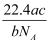 L
D .
L
D . 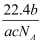 L
L
某同学设计用下图的装置制备少量的AlCl3(易水解)。下列说法错误的是( )

A . G装置作用是除去多余氯气,防止空气污染
B . 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人E中
C . 用50mL12mol/L的盐酸与足量的MnO2反应,所得氯气可以制取26.7gAlCl3
D . 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
-
(1) 11g CO2的物质的量是多少摩?
-
(2) 用18 mol/L 的浓硫酸配制 1.8mol/L的稀硫酸 1000 m L ,需浓硫酸的体积是多少升?
NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A . 1L0.1mol/L的 NaHCO3溶液中HCO3-和CO32-的离子数之和为0.1NA
B . 常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
C . 12g石墨和C60的混合固体中,含NA个碳原子
D . 电解精炼铜时,电路中每转移0.2NA个电子,阳极质量就会减少6.4g
下列溶液中的c(Cl-)与50mL1mol·L-1 AlCl3溶液中的c(Cl-)相等的是( )
A . 150mL1mol·L-1 NaCl溶液
B . 75mL2mol·L-1 FeCl3溶液
C . 75mL2mol·L-1 BaCl2溶液
D . 150mL3mol·L-1 KCl溶液
NA代表阿伏加德罗常数,下列有关叙述正确的是( )
A . 50mL18.4mol•L﹣1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
B . 足量的Fe粉与1molCl2充分反应转移的电子数为2NA
C . 0.78gNa2O2中含有离子总数为0.04NA
D . 标准状况下,44.8L四氯化碳含有的分子数为2NA
设  为阿伏加德罗常数的值,下列说法中正确的是( )
为阿伏加德罗常数的值,下列说法中正确的是( )
 为阿伏加德罗常数的值,下列说法中正确的是( )
为阿伏加德罗常数的值,下列说法中正确的是( )
A . 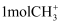 正离子所含的电子总数为
正离子所含的电子总数为 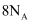 B .
B .  与
与  混合气体中所含原子总数为
混合气体中所含原子总数为  C . 常温常压下,
C . 常温常压下, 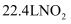 和
和  混合气体中含有
混合气体中含有  个氧原子
D . 电解
个氧原子
D . 电解  溶液共得到
溶液共得到 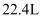 气体(标准状况),理论上转移了
气体(标准状况),理论上转移了  个电子
个电子
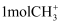 正离子所含的电子总数为
正离子所含的电子总数为 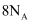 B .
B .  与
与  混合气体中所含原子总数为
混合气体中所含原子总数为  C . 常温常压下,
C . 常温常压下, 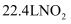 和
和  混合气体中含有
混合气体中含有  个氧原子
D . 电解
个氧原子
D . 电解  溶液共得到
溶液共得到 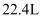 气体(标准状况),理论上转移了
气体(标准状况),理论上转移了  个电子
个电子
世界某著名学术刊物介绍了一种新型中温全瓷铁-空气电池,其结构如图所示。下列有关该电池放电时的说法正确的是( )
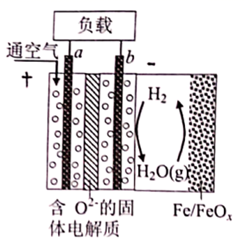
A . a极为原电池的负极
B . 正极的电极反应式为 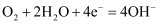 C . 放电时电子从b极经固体电解质流向a极
D . 消耗掉
C . 放电时电子从b极经固体电解质流向a极
D . 消耗掉 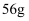 铁时,理论上要消耗
铁时,理论上要消耗 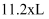 标准状况的
标准状况的 
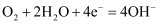 C . 放电时电子从b极经固体电解质流向a极
D . 消耗掉
C . 放电时电子从b极经固体电解质流向a极
D . 消耗掉 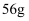 铁时,理论上要消耗
铁时,理论上要消耗 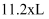 标准状况的
标准状况的 
已知  为阿伏加德罗常数的值,下列说法错误的是( )
为阿伏加德罗常数的值,下列说法错误的是( )
 为阿伏加德罗常数的值,下列说法错误的是( )
为阿伏加德罗常数的值,下列说法错误的是( )
A .  中含有的中子数为
中含有的中子数为  B .
B . 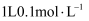 碳酸钠溶液中含有的
碳酸钠溶液中含有的  数目为
数目为  C .
C .  被还原为
被还原为  时,当生成
时,当生成  ,转移的电子数为
,转移的电子数为 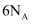 D .
D . 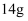 乙烯中含有的共用电子对的数目为
乙烯中含有的共用电子对的数目为 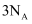
 中含有的中子数为
中含有的中子数为  B .
B . 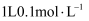 碳酸钠溶液中含有的
碳酸钠溶液中含有的  数目为
数目为  C .
C .  被还原为
被还原为  时,当生成
时,当生成  ,转移的电子数为
,转移的电子数为 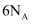 D .
D . 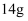 乙烯中含有的共用电子对的数目为
乙烯中含有的共用电子对的数目为 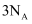
设NA为阿伏加德罗常数的值。下列说法错误的是( )
A . 常温常压下,1.0molFe和足量浓硝酸混合反应,转移电子数为3NA
B . 等质量的乙烯和丙烯中含有的共用电子对数相等
C . 常温下,1.0LpH=13的Ba(OH)2溶液中含OH-的数目为0.1NA
D . 0.1mol的11B中,含有0.6NA个中子
设N表示阿伏加德罗常数的值。下列说法正确的是( )
A . 14 g聚丙烯中含C一H键总数目为2NA
B . 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
C . 2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
D . 电解精炼铜时,若阳极质量减少64 g,则阴极得到电子的数目为2NA
青蒿素是一种用于治疗疟疾的药物,我国药学家屠呦呦因发现青蒿素于2015年10月获得了诺贝尔生理学或医学奖。下列有关青蒿素(化学式:C15H22O5)的叙述正确的是( )
A . 青蒿素的摩尔质量为282g
B . 282g青蒿素中含C原子个数为15mol
C . 青蒿素中C、O两种元素质量比为15:22
D . 141g青蒿素所含分子数为0.5NA
最近更新



