离子方程式的书写 知识点题库
下列离子方程式书写正确的是( )
A . 向碳酸钠溶液中滴加与其溶质的物质的量相等的盐酸:CO  +2H+═CO2↑+H2O
B . 向苯酚钠溶液中通入少量的CO2:
+2H+═CO2↑+H2O
B . 向苯酚钠溶液中通入少量的CO2: 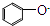 +CO2+H2O→
+CO2+H2O→  +HCO
+HCO  C . 足量铁粉与稀硝酸反应:Fe+4H++NO
C . 足量铁粉与稀硝酸反应:Fe+4H++NO  ═Fe3++2H2O+NO↑
D . 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
═Fe3++2H2O+NO↑
D . 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
 +2H+═CO2↑+H2O
B . 向苯酚钠溶液中通入少量的CO2:
+2H+═CO2↑+H2O
B . 向苯酚钠溶液中通入少量的CO2:  C . 足量铁粉与稀硝酸反应:Fe+4H++NO
C . 足量铁粉与稀硝酸反应:Fe+4H++NO  ═Fe3++2H2O+NO↑
D . 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
═Fe3++2H2O+NO↑
D . 向漂白粉溶液中通入少量二氧化硫:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
下列各式中属于正确的水解反应的离子方程式的是( )
A . CH3COOH+OH﹣⇌CH3COO﹣+H2O
B . S2﹣+2H2O⇌H2S+2OH﹣
C . CH3COOH+H2O⇌CH3COO﹣+H3O+
D . NH4++H2O⇌NH3•H2O+H+
现有下列十种物质:①液态HCl ②NaHCO3③NaCl溶液 ④CO2⑤蔗糖晶体 ⑥Ba(OH)2⑦红褐色的氢氧化铁胶体 ⑧NH3⑨空气 ⑩Al2(SO4)3
-
(1) 上述十种物质中有两种物质在水溶液中可发生反应,离子方程式为:H++OH﹣═H2O,该反应的化学方程式为.
-
(2) ⑩在水中的电离方程式为,
-
(3) 胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水.医生常用胃舒平(主要成分氢氧化铝)来治疗,它与胃酸反应的离子方程式:.
-
(4) 上述十种物质中属于电解质的是:.(填序号)
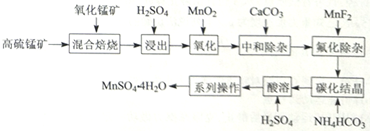
硫酸锰是一种重要的化工中间体,是锰行业研究的热点。一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:
已知:
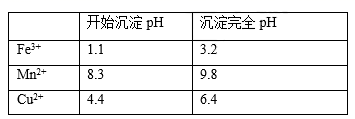
①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):
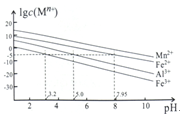
③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:
-
(1) 传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为。
-
(2) “氧化”时,发生反应的离子方程式为。若省略“氧化”步骤,造成的后果是。
-
(3) “中和除杂”时,生成沉淀的主要成分为(填化学式)。
-
(4) “氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于。(已知:Ksp(MgF2)=6.4×10-10;Ksp(CaF2)=3.6×10-12)
-
(5) “系列操作”指、过滤、洗涤、干燥。
下列离子方程式的书写及评价均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2 mol Cl2通入含1 mol FeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 符合题意;Cl2过量,可将Fe2+、I-均氧化 |
| B | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3-+OH-=BaCO3↓+H2O | 符合题意;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 符合题意;说明酸性:H2SO3强于HClO |
| D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 符合题意;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A . A
B . B
C . C
D . D
下列指定反应的离子方程式正确的是( )
A . BaSO3与稀HNO3反应:BaSO3+2H+=Ba2++SO2↑+H2O
B . 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C . 酸性溶液中KIO3与KI反应生成I2:IO3−+I−+6H+=I2+3H2O
D . Ca(OH)2溶液与过量NaHCO3溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
用含有少量SiO2、Fe2O3杂质的辉铜矿(主要成分Cu2S)和软锰矿(主要成分MnO2),制备碱式碳酸铜,可进一步制取有机合成中的催化剂氯化亚铜(CuCl),其主要工艺流程如图:
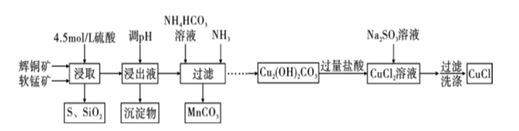
已知:①MnO2能氧化硫化物生成S;
②部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示:
③CuCl是一种白色粉末,难溶于水,可溶于氯离子浓度较大的体系。
-
(1) 浸出液中含有CuSO4和MnSO4等主要产物,写出生成该主要产物的化学方程式:。
-
(2) 实验室中用18.4mol/L的浓硫酸配制480mL4.5mol/L的硫酸溶液需要使用的玻璃仪器有烧杯、玻璃棒、量筒、、。
-
(3) 沉淀物的主要成分是。
-
(4) 结合已知条件,实验室中若选用饱和Na2CO3溶液(pH约为12)和MnSO4溶液作为反应原料制备MnCO3沉淀,采用的加料方式是将溶液缓慢加入到盛有溶液的反应容器中。
-
(5) CuCl2溶液中加入Na2SO3溶液的离子反应方程式为。
-
(6) 得到的CuCl晶体需用水洗涤,洗涤CuCl晶体的操作是。
-
(7) CuCl晶体在碱性溶液中可以制得氧化亚铜,该反应的离子反应方程式为。
下列离子方程式书写正确的是( )
A . AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓
B . 铝粉投入到NaOH溶液中:2Al+2OH- = 2AlO2-+H2↑
C . 钠和冷水反应:2Na+2H2O=2Na++2OH-+H2↑
D . 向澄清石灰水中滴入足量碳酸氢钠溶液:Ca2++OH-+HCO3- =CaCO3↓+H2O
下列化学反应的离子方程式书写正确的是( )
A . 碳酸钙溶解于盐酸:CO32-+2H+=CO2↑+H2O
B . 单质铁与稀硫酸反应:2Fe+6H+=3H2↑+2Fe3+
C . 氨气通入醋酸溶液:CH3COOH+NH3=CH3COO-+NH4+
D . 过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O
下列离子方程式书写正确的是( )
A . 用KIO3氧化酸性溶液中的KI:  B . 草酸溶液使酸性KMnO4溶液褪色:
B . 草酸溶液使酸性KMnO4溶液褪色: 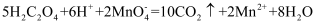 C . 铅蓄电池充电时正极反应:
C . 铅蓄电池充电时正极反应:  D . Na2S2O3溶液中加入稀硫酸:
D . Na2S2O3溶液中加入稀硫酸: 
 B . 草酸溶液使酸性KMnO4溶液褪色:
B . 草酸溶液使酸性KMnO4溶液褪色: 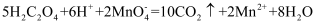 C . 铅蓄电池充电时正极反应:
C . 铅蓄电池充电时正极反应:  D . Na2S2O3溶液中加入稀硫酸:
D . Na2S2O3溶液中加入稀硫酸: 
下列离子方程式书写正确的是( )
A . 铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B . 氢氧化铜溶液与硫酸溶液的反应:Cu(OH)2+2H+=Cu2++2H2O
C . 碳酸钙与盐酸反应:  +2H+=CO2↑+H2O
D . 硫酸铜溶液和氢氧化钡溶液:Ba2++
+2H+=CO2↑+H2O
D . 硫酸铜溶液和氢氧化钡溶液:Ba2++  =BaSO4↓
=BaSO4↓
 +2H+=CO2↑+H2O
D . 硫酸铜溶液和氢氧化钡溶液:Ba2++
+2H+=CO2↑+H2O
D . 硫酸铜溶液和氢氧化钡溶液:Ba2++  =BaSO4↓
=BaSO4↓
现有以下物质:①Cu②熔融NaCl③NaHSO4固体④NH3⑤蔗糖⑥CaO⑦盐酸,请按下列分类标准回答问题(用序号填写)。
-
(1) 能导电的是;
-
(2) 属于电解质的是,属于非电解质的是;
-
(3) 写出③在水溶液中的电离方程式;
-
(4) 向⑥中滴加⑦溶液的离子方程式为。
下列离子方程式正确的是( )
A . 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+3H2O
B . 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2﹣+CO2+2H2O═Al(OH)3↓+HCO3-
C . 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl﹣  Mn2++Cl2↑+2H2O
D . 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
Mn2++Cl2↑+2H2O
D . 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
 Mn2++Cl2↑+2H2O
D . 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
Mn2++Cl2↑+2H2O
D . 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO﹣+2Fe(OH)3═2FeO42﹣+3Cl﹣+H2O+4H+
下列离子方程式正确的是( )
A . NaHSO4溶液中加入Ba(OH)2溶液至沉淀完全:  + H++ Ba2++ OH-= BaSO4↓+ H2O
B . NaHCO3溶液中加入过量石灰水:2
+ H++ Ba2++ OH-= BaSO4↓+ H2O
B . NaHCO3溶液中加入过量石灰水:2  + Ca2++ 2OH-= CaCO3↓ + 2H2O +
+ Ca2++ 2OH-= CaCO3↓ + 2H2O +  C . 稀硝酸中加入少量亚硫酸钠:2H++
C . 稀硝酸中加入少量亚硫酸钠:2H++  =SO2↑+H2O
D . Na2CO3溶液与醋酸溶液混合:2H+ +
=SO2↑+H2O
D . Na2CO3溶液与醋酸溶液混合:2H+ +  = CO2↑ +H2O
= CO2↑ +H2O
 + H++ Ba2++ OH-= BaSO4↓+ H2O
B . NaHCO3溶液中加入过量石灰水:2
+ H++ Ba2++ OH-= BaSO4↓+ H2O
B . NaHCO3溶液中加入过量石灰水:2  + Ca2++ 2OH-= CaCO3↓ + 2H2O +
+ Ca2++ 2OH-= CaCO3↓ + 2H2O +  C . 稀硝酸中加入少量亚硫酸钠:2H++
C . 稀硝酸中加入少量亚硫酸钠:2H++  =SO2↑+H2O
D . Na2CO3溶液与醋酸溶液混合:2H+ +
=SO2↑+H2O
D . Na2CO3溶液与醋酸溶液混合:2H+ +  = CO2↑ +H2O
= CO2↑ +H2O
能正确表示下列变化的离子方程式是( )
A . 向Ca(HCO)2溶液中加入足量Ca(OH)2溶液:  B . 泡沫灭火器原理:
B . 泡沫灭火器原理: 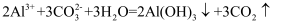 C . 过量铁粉与稀硝酸反应:
C . 过量铁粉与稀硝酸反应: 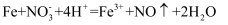 D . 纯碱溶液显碱性的原因:
D . 纯碱溶液显碱性的原因: 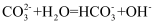
 B . 泡沫灭火器原理:
B . 泡沫灭火器原理: 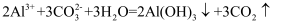 C . 过量铁粉与稀硝酸反应:
C . 过量铁粉与稀硝酸反应: 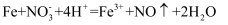 D . 纯碱溶液显碱性的原因:
D . 纯碱溶液显碱性的原因: 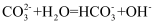
有以下几种物质:①铁 ②液态的HCl ③蔗糖 ④酒精 ⑤稀盐酸 ⑥H2SO4 ⑦KOH ⑧熔融的KNO3 ⑨O2
⑩干冰。试回答(填序号):
-
(1) 以上物质能导电的是。
-
(2) 以上物质中属于非电解质的是。
-
(3) 以上物质中溶于水后水溶液能导电的是。
-
(4) ②、⑦在水溶液中反应的离子方程式为。
某兴趣小组的同学向一定体积的 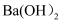 溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。下列说法不正确的是( )
溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。下列说法不正确的是( )
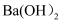 溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。下列说法不正确的是( )
溶液中逐滴加入稀硫酸,并测得混合溶液的导电能力随时间变化的曲线如图所示。下列说法不正确的是( ) 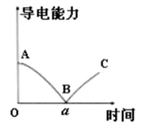
A . AB 段发生反应的离子反应方程式为:  B . B 处溶液的导电能力约为 0,并不能说明生成的
B . B 处溶液的导电能力约为 0,并不能说明生成的  不是电解质
C . a 时刻
不是电解质
C . a 时刻 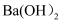 溶液与稀硫酸恰好完全中和
D . BC 段溶液导电能力不断增大,主要是由于过量硫酸电离出的离子导电
溶液与稀硫酸恰好完全中和
D . BC 段溶液导电能力不断增大,主要是由于过量硫酸电离出的离子导电
 B . B 处溶液的导电能力约为 0,并不能说明生成的
B . B 处溶液的导电能力约为 0,并不能说明生成的  不是电解质
C . a 时刻
不是电解质
C . a 时刻 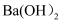 溶液与稀硫酸恰好完全中和
D . BC 段溶液导电能力不断增大,主要是由于过量硫酸电离出的离子导电
溶液与稀硫酸恰好完全中和
D . BC 段溶液导电能力不断增大,主要是由于过量硫酸电离出的离子导电
过去电子工业常用30%的FeCl3溶液腐蚀覆有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为3FeCl3+Cu=2FeCl2+CuCl2。
-
(1) 检验腐蚀后的溶液中含有Fe3+应选用的试剂是,上述反应说明Fe3+、Cu2+氧化性的强弱关系为。
-
(2) 采用下列实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液的流程如图所示。
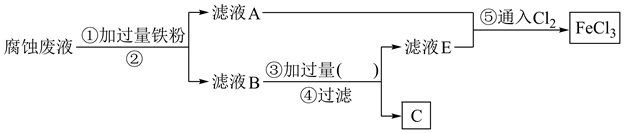
①滤液A中主要含有(填化学式,下同),滤渣B主要为。
②流程图中②的操作名称为,③处加过量的(填名称)。
③写出步骤⑤中反应的离子方程式:。
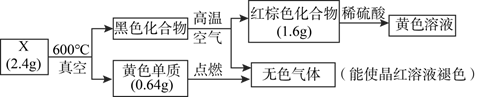
为探究某固体化合物X(仅含两种元素)的组成和性质,设计并完成如下实验,请回答:
-
(1) 组成物质X的元素是。
-
(2) 黑色化合物转化为红棕色化合物的方程式为。
-
(3) 写出红棕色化合物与稀硫酸反应的离子方程式:
-
(4) 设计实验方案检验黄色溶液中的金属阳离子
化合物X在工业、农业生产中都有重要用途,X由4种常见元素组成,某兴趣小组展开如下实验(气体的体积均在标准状况下测得):
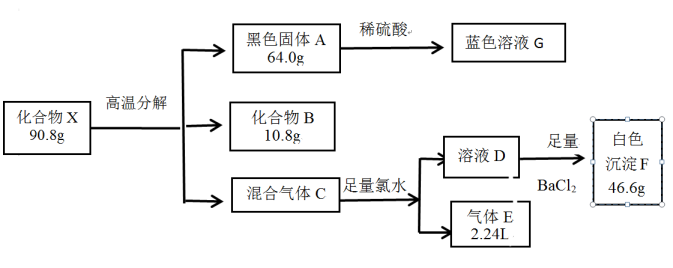
已知:①X的摩尔质量为454g·mol-1;②化合物B常温下是常见的液体;③混合气体C能使品红溶液褪色,气体E能使带火星的木条复燃。
请回答:
-
(1) 白色沉淀F的化学式是,化合物X的化学式是。
-
(2) 混合气体C与足量氯水反应的离子方程式为。
-
(3) 化合物X高温分解的化学方程式为。
-
(4) 蓝色溶液G 与NaOH溶液发生非氧化还原反应可制得X,化学方程式为。
最近更新



