离子方程式的书写 知识点题库
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中,正确的是( )
A . 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-=Cl2↑
B . 明矾净水时,主要反应的离子方程式为: Al3++3H2O=Al(OH)3 ↓+3H+
C . 氢硫酸的电离方程式为:H2S  2H++S2-
D . 钢铁发生电化学腐蚀的正极反应式:Fe-2e—
2H++S2-
D . 钢铁发生电化学腐蚀的正极反应式:Fe-2e— Fe2+
Fe2+
 2H++S2-
D . 钢铁发生电化学腐蚀的正极反应式:Fe-2e—
2H++S2-
D . 钢铁发生电化学腐蚀的正极反应式:Fe-2e— Fe2+
Fe2+
将a L(标准状况)CO2通入100mL 3mol·L-1 NaOH溶液中,下列各项为通入CO2过程中溶液内发生反应的离子方程式,其中不正确的是 ( )
A . a =6.72时,CO2+OH- = HCO B . a =3.36时,CO2+2OH- = CO
B . a =3.36时,CO2+2OH- = CO +H2O
C . a =4.48时,2CO2+3OH- = CO
+H2O
C . a =4.48时,2CO2+3OH- = CO +HCO
+HCO +H2O
D . a =8.96时,3CO2+4OH- = CO
+H2O
D . a =8.96时,3CO2+4OH- = CO +2HCO
+2HCO +H2O
+H2O
 B . a =3.36时,CO2+2OH- = CO
B . a =3.36时,CO2+2OH- = CO +H2O
C . a =4.48时,2CO2+3OH- = CO
+H2O
C . a =4.48时,2CO2+3OH- = CO +HCO
+HCO +H2O
D . a =8.96时,3CO2+4OH- = CO
+H2O
D . a =8.96时,3CO2+4OH- = CO +2HCO
+2HCO +H2O
+H2O
下列离子方程式正确的是( )
A . 向澄清石灰水中加入等物质的量的NaHCO3溶液:Ca2++2OH﹣+2HCO  ═CaCO3↓+CO
═CaCO3↓+CO  +2H2O
B . 向NH4HSO4稀溶液中加入NaOH稀溶液少量:OH﹣+NH
+2H2O
B . 向NH4HSO4稀溶液中加入NaOH稀溶液少量:OH﹣+NH  ═NH3•H2O
C . 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
D . 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I﹣+2H+═I2+2H2O
═NH3•H2O
C . 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
D . 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I﹣+2H+═I2+2H2O
 ═CaCO3↓+CO
═CaCO3↓+CO  +2H2O
B . 向NH4HSO4稀溶液中加入NaOH稀溶液少量:OH﹣+NH
+2H2O
B . 向NH4HSO4稀溶液中加入NaOH稀溶液少量:OH﹣+NH  ═NH3•H2O
C . 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
D . 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I﹣+2H+═I2+2H2O
═NH3•H2O
C . 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
D . 向淀粉KI溶液中滴加酸性H2O2溶液,溶液变蓝色:H2O2+2I﹣+2H+═I2+2H2O
25℃时,将0.01mol CH3COONa 和0.002mol HCl溶于水,形成1L混合溶液:
-
(1) 该溶液中存在三个平衡体系,用电离方程式或离子方程式表示:
①②③.
-
(2) 溶液中共有种不同的粒子(指分子和离子).
-
(3) 在这些粒子中,浓度为0.01mol/L的是,浓度为0.002mol/L的是.
表示下列反应的离子方程式正确的是( )
A . 铁溶于稀盐酸:2Fe+6H+=2Fe3++3H2↑
B . 氯化铝溶液中加过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+
C . 碳酸氢铵溶液中加足量氢氧化钠并加热:NH4++OH﹣  H2O+NH3↑
D . 氯气通入水中,溶液呈酸性:Cl2+H2O⇌2H++Cl﹣+ClO﹣
H2O+NH3↑
D . 氯气通入水中,溶液呈酸性:Cl2+H2O⇌2H++Cl﹣+ClO﹣
 H2O+NH3↑
D . 氯气通入水中,溶液呈酸性:Cl2+H2O⇌2H++Cl﹣+ClO﹣
H2O+NH3↑
D . 氯气通入水中,溶液呈酸性:Cl2+H2O⇌2H++Cl﹣+ClO﹣
下列反应的离子方程式中,正确的是( )
A . 稀硫酸滴在银片上:2Ag+2H+=2Ag++H2↑
B . 氧化铁与稀盐酸混合:Fe2O3+6H+=2Fe3++3H2O
C . 碳酸钙溶于醋酸溶液中:CaCO3+2H+=Ca2++CO2↑+H2O
D . 澄清石灰水与稀硝酸反应:Ca(OH)2+2H+=Ca2++2H2O
写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸溶液反应;
②碳酸钙和足量稀盐酸反应;
③氧化铁和稀盐酸反应:;
④少量CO2气体通入澄清石灰水.
下列指定反应的离子方程式正确的是( )
A . 向FeCl3溶液中滴加HI溶液:Fe3++2I﹣═Fe2++I2
B . 向AlCl3溶液中加入过量的氨水:Al3++4NH3•H2O═Al  +4N
+4N  +2H2O
C . 向稀NH4HCO3溶液中加入过量NaOH溶液:N
+2H2O
C . 向稀NH4HCO3溶液中加入过量NaOH溶液:N  +OH﹣═NH3•H2O
D . 向苯酚钠溶液中通入少量CO2:
+OH﹣═NH3•H2O
D . 向苯酚钠溶液中通入少量CO2: ﹣
﹣
 +4N
+4N  +2H2O
C . 向稀NH4HCO3溶液中加入过量NaOH溶液:N
+2H2O
C . 向稀NH4HCO3溶液中加入过量NaOH溶液:N  +OH﹣═NH3•H2O
D . 向苯酚钠溶液中通入少量CO2:
+OH﹣═NH3•H2O
D . 向苯酚钠溶液中通入少量CO2:
下列离子方程式书写符合题意且能合理解释事实的是( )
A . Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-= CaCO3↓+CO32-+H2O
B . 用Na2CO3溶液浸泡锅炉水垢:CaSO4(s)+CO32-= CaCO3(s)+ SO42-
C . 用FeCl3溶液腐蚀印刷线路板上的Cu:Fe3++ Cu= Fe2++ Cu2+
D . 明矾溶于水产生Al(OH)3胶体:Al3++3H2O = Al(OH)3↓+3H+
下列指定反应的离子方程式正确的是( )
A . 用Ba(OH)2溶液吸收氯气:2OH-+ 2Cl2 =2Cl-+ClO-+H2O
B . Cu 溶于稀HNO3: Cu + 2H++ NO3- = Cu2+ + NO2↑+ H2O
C . NO2溶于水:3NO2+H2O =2H++2NO3- +NO
D . 氯化镁溶液与氨水反应:Mg2+ + 2OH-= Mg(OH)2↓
已知X、Y、Z、W四种元素是短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W是该元素所在周期原子半径最大的元素,W原子的质子数等于Y、Z原子的最外层电子数之和。Y与X形成的分子中有3个共价键,该分子中含有10个电子。Z原子最外层电子数是次外层电子数的3倍,试判断:
-
(1) X、Z两种元素的元素符号为X,Z。
-
(2) 由以上元素两两形成的化合物中:溶于水显碱性的气态氢化物的电子式为。
-
(3) ①由X、Y、Z所形成的常见离子化合物是(写化学式)。
②该化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为。
③化合物WY3的晶体结构中含有的化学键为(选填序号)。
A.只含离子键
B.只含共价键
C.既含离子键又含共价键
④X与W形成的化合物与水反应时,水作(填“氧化剂”或“还原剂”)。
-
(4) 用电子式表示化合物W2Z的形成过程:。
-
(1) 泡沫灭火器内装有NaHCO3饱和溶液,该溶液呈(填酸性、碱性、中性),原因(用离子方程式解释);灭火器中另一容器装有Al2(SO4)3溶液,该溶液呈(填酸性、碱性、中性),原因(用离子方程式释)当意外失火时,使泡沫灭火器倒过来即可使药液混合,喷出CO2和Al(OH) 3,阻止火势蔓延。原因(用离子方程式解释)
-
(2) 已知25℃,AgI的饱和溶液中,c(Ag+)=1.22×10-8mol/L,AgCl的饱和溶液中,c(Ag+)=1.25×10-5mol/L。若在5ml含有KCl和KI各为0.01mol/L的溶液中,加入8ml 0.01mol/L AgNO3溶液,这时溶液中所含溶质的离子浓度由大到小的次序是
-
(3) 在某温度下,将H2和I2各0.10mol的气态混合物充入10L的密闭容器中充分反应,达到平衡后,测得c(H2)=0.0080mol/L。该反应的平衡常数 K=;在上述温度下,该容器中若通入H2和I2蒸气各0.20mol,求达到化学平衡状态时c(H2)= ,c(I2)= ,c(HI)=
下列离子反应方程式书写正确的是( )
A . 往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO32-=HCO3-
B . 草酸(H2C2O4)溶液中加入酸性KMnO4溶液:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O
C . 往少量澄清石灰水中加入Ca(HCO3)2溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D . 用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。
请回答下列问题:
-
(1) 写出A、B、C、D、E、F的化学式
A;B;C;D;E;F。
-
(2) 写出F和H反应的化学方程式。
-
(3) 写出下列反应的离子方程式:
①D+盐酸;
②B+水;
③D+A。
能正确表示下列反应的离子方程式是( )
A . 氢氧化铁溶于氢碘酸(强酸):Fe(OH)3+3H+=Fe3++3H2O
B . 碳酸钠溶液水解:  +H3O+
+H3O+ 
 +H2O
C . Na2SiO3溶液与醋酸混合:
+H2O
C . Na2SiO3溶液与醋酸混合:  +2H+= H2SiO3↓
D . 0.2mol∙L-1KAl(SO4)2与0.3mol∙L-1Ba(OH)2溶液等体积混合:2Al3++3
+2H+= H2SiO3↓
D . 0.2mol∙L-1KAl(SO4)2与0.3mol∙L-1Ba(OH)2溶液等体积混合:2Al3++3  +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
 +H3O+
+H3O+ 
 +H2O
C . Na2SiO3溶液与醋酸混合:
+H2O
C . Na2SiO3溶液与醋酸混合:  +2H+= H2SiO3↓
D . 0.2mol∙L-1KAl(SO4)2与0.3mol∙L-1Ba(OH)2溶液等体积混合:2Al3++3
+2H+= H2SiO3↓
D . 0.2mol∙L-1KAl(SO4)2与0.3mol∙L-1Ba(OH)2溶液等体积混合:2Al3++3  +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
能正确表示下列化学反应的离子方程式的是( )
A . 氢氧化钡溶液与稀硫酸的反应OH-+H+=H2O
B . 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
C . 铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D . 石灰石溶于稀盐酸中CaCO3+2H+=Ca2++H2O+CO2
下列反应的现象描述与离子方程式都正确的是( )
A . 钠与冷水反应:有氢气产生;Na + 2H2O = Na+ + H2↑
B . 铁跟稀硫酸反应: 2Fe + 6H+ = 2Fe3+ + 3H2↑
C . 氧化镁与稀盐酸反应: 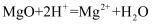 D . 实验室用浓盐酸与
D . 实验室用浓盐酸与  反应制
反应制  :
: 
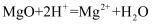 D . 实验室用浓盐酸与
D . 实验室用浓盐酸与  反应制
反应制  :
: 
按要求书写化学用语
-
(1) 氯酸钾溶于水的电离方程式:。
-
(2) 稀硫酸和氧化铝反应的离子方程式:。
-
(3) 硫酸氢钠溶液和小苏打溶液反应的离子方程式:。
-
(4) 用离子方程式表示实验室中二氧化碳气体的检验:。
-
(5) 高锰酸钾溶液和浓盐酸能够发生反应:2KMnO4+16HCl(浓)=2MnCl2+5Cl2↑+8H2O+2KCl,写出该反应的离子方程式:。
下列离子方程书写错误的是( )
A . 向 FeI2、FeBr2的混合溶液中通入少量氯气:2I-+Cl2= I2+2Cl-
B . 过量Ca(HCO3)2溶液与Ca(OH)2溶液反应:HCO + Ca2+ + OH- = CaCO3↓ + H2O
C . 向 NaHCO3溶液中加入氯化铁溶液:3HCO
+ Ca2+ + OH- = CaCO3↓ + H2O
C . 向 NaHCO3溶液中加入氯化铁溶液:3HCO +Fe3+ =3CO2↑+Fe(OH)3↓
D . AgCl悬浊液中滴入Na2S溶液:2Ag++S2- =Ag2S↓
+Fe3+ =3CO2↑+Fe(OH)3↓
D . AgCl悬浊液中滴入Na2S溶液:2Ag++S2- =Ag2S↓
 + Ca2+ + OH- = CaCO3↓ + H2O
C . 向 NaHCO3溶液中加入氯化铁溶液:3HCO
+ Ca2+ + OH- = CaCO3↓ + H2O
C . 向 NaHCO3溶液中加入氯化铁溶液:3HCO +Fe3+ =3CO2↑+Fe(OH)3↓
D . AgCl悬浊液中滴入Na2S溶液:2Ag++S2- =Ag2S↓
+Fe3+ =3CO2↑+Fe(OH)3↓
D . AgCl悬浊液中滴入Na2S溶液:2Ag++S2- =Ag2S↓
我国科学家利用Co的化合物在Fe(OH)2氧化过程中的催化作用,促进了电催化过程中流失的Fe催化活性中心的原位自修复(Fe再沉积的主要反应过程) ,反应机理如图所示。下列说法错误的是( )

A . 反应过程中CoOOH为催化剂
B . 图中各反应不能在酸性条件下进行
C . 存在反应Co(OH)2+OH- -e- =CoOOH+H2O
D . 图中所示物质之间的转化有非极性键的形成和断裂
最近更新



