离子方程式的书写 知识点题库
下列反应的离子方程式书写正确的是( )
A . 铁粉与稀盐酸的反应:Fe+2H+═Fe2++H2↑
B . 硫酸铝溶液与氨水的反应:Al3++3OH﹣═Al(OH)3↓
C . 氢氧化铜与稀硫酸的反应:OH﹣+H+═H2O
D . 钠与水的反应:Na+2H2O═Na++2OH﹣+H2↑
下列反应的离子方程式书写正确的是( )
A . 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu
B . 稀硫酸与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C . 碳酸钙与盐酸反应:2H++CO32﹣=H2O+CO2↑
D . 氢氧化钡溶液与稀硫酸反应:Ba2++SO42﹣=BaSO4↓
下列反应的离子方程式正确的是( )
A . 用KIO3 氧化酸性溶液中的KI:5I﹣+IO3﹣+3H2O═3I2+6OH﹣
B . 向Ca(ClO)2溶液中通入过量CO2制次氯酸:ClO﹣+H2O+CO2═HClO+HCO3﹣
C . 向酸性KMnO 4溶液中滴入H 2O2:2MnO 4﹣+6H++3H2O2═2Mn 2++4O2↑+6H2O
D . 用Cl2与石灰乳反应制漂白粉:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O
下列表示对应化学反应的离子方程式正确的是 ( )
A . 向稀HNO3中滴加Na2SO3溶液: SO32-+2H+=SO2↑+H2O
B . 向Na2SiO3溶液中通入过量SO2:SiO32-+SO2+H2O=H2SiO3↓+SO32-
C . 向Al2(SO4)3溶液中加入过量的NH3·H2O: Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D . 向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
能正确表示下列反应的离子方程式是( )
A . Fe3O4 溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B . 硫化钠的水解反应:S2-+H3O+  HS-+H2O
C . 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D . NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
HS-+H2O
C . 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D . NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
 HS-+H2O
C . 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D . NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
HS-+H2O
C . 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
D . NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。(部分产品未标出)

-
(1) Ⅰ中发生反应的还原剂是、Ⅱ中的氧化剂是(填化学式)。
-
(2) Ⅱ中反应的离子方程式是。
-
(3) ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2 + 4HCl = 5NaCl + 4ClO2↑+ 2H2O。
①该反应中氧化剂和还原剂的物质的量之比是。
②研究表明:在上述过程中会发生副反应:NaClO2 + 4HCl = NaCl + 2Cl2↑+ 2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因是。
下列离子方程式正确的是( )
A . 澄清的石灰水与盐酸反应:Ca(OH)2+2H+=Ca2++2H2O
B . 硫酸和氢氧化钡溶液反应:H++OH-=H2O
C . 铜片插入硝酸银溶液: Cu+Ag+=Cu2++Ag
D . 大理石溶于醋酸:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
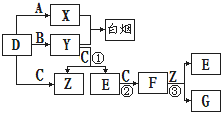
A,B,C,D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。
请回答下列问题:
-
(1) D的化学式为 。
-
(2) 反应③的离子方程式为 。
-
(3) Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为 。
下列离子方程式正确的是( )
A . 向Na2S2O3溶液中通入足量氯气:S2O32-+ 2Cl2+3H2O=2SO32-+4Cl-+6H+
B . CuSO4溶液吸收H2S 气体:Cu2++H2S= CuS↓+2H+
C . AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
D . 等体积、等浓度的Ba(OH)2稀溶液与NaHSO4稀溶液混合: Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
-
(1) 要确定铁的某氯化物FeClx的化学式。可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预防处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值。
-
(2) 现有一含有FeCl2和FeCl3的混合样品,采用上述方法测得n(Fe): n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为。在实验室中,FeCl2可用铁粉和反应制备,FeCl3可用铁粉和反应制备。
-
(3) FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为。
-
(4) 高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4 , 其反应的离子方程式为。
能用H+ + OH- = H2O 来表示的化学反应是:( )
A . Ba(OH)2溶液和HNO3溶液反应
B . NH3·H2O溶于稀H2SO4
C . KOH溶液和CH3COOH溶液反应
D . Ba(OH)2 溶液和H2SO4溶液反应
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发)下列说法正确的是( )
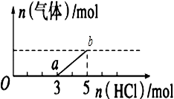
A . oa段反应的离子方程式为:H++OH-=H2O
B . O点溶液中所含溶质的化学式为NaHCO3、Na2CO3
C . 标准状况下,通入CO2的体积为4.48L
D . 原NaOH溶液的物质的量浓度为2.5mol•L﹣1
现有物质 ①铜 ②干冰
③盐酸
④液态醋酸 ⑤蔗糖
⑥NaHSO4 固体
⑦Ba(OH)2溶液
⑧ 熔融的
NaCl
-
(1) 能导电的是:属于电解质的是:
-
(2) 将NaHSO4固体溶于水,写出NaHSO4的电离方程式:
-
(3) ① 向Ba(OH)2溶液中逐滴滴加NaHSO4溶液至 Ba2+恰好完全沉淀,发生反应的离子方程式为: ;
②Ba2+恰好沉淀后继续滴加NaHSO4溶液时,发生反应的离子方程式为:
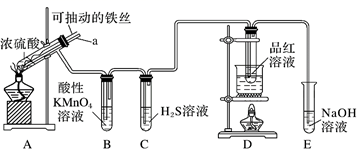
实验室为探究铁与浓硫酸的反应,并验证SO2的性质,设计如图所示装置进行实验。
请回答下列问题:
-
(1) 装置B中酸性KMnO4溶液逐渐褪色,则装置B中发生反应的离子方程式是;装置C中发生反应的化学方程式是。
-
(2) 装置D的作用是;实验结束时需从导管a通入大量空气,其目的是。
-
(3) 实验时将导管a插入试管中,可使装置B中的溶液不发生倒吸。其原因是。
-
(4) 若装置A反应后的溶液中金属阳离子只含有Fe3+ , 则装置A中发生反应的化学方程式为。
亚硝酰氯( 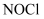 )是一种黄色气体,沸点为
)是一种黄色气体,沸点为  ℃。其液体呈红褐色。遇水发生反应:
℃。其液体呈红褐色。遇水发生反应: 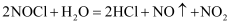 。某化学兴趣小组设计如图装置用
。某化学兴趣小组设计如图装置用  和
和 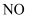 制备
制备 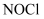 。回答下列相关问题:
。回答下列相关问题:
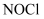 )是一种黄色气体,沸点为
)是一种黄色气体,沸点为  ℃。其液体呈红褐色。遇水发生反应:
℃。其液体呈红褐色。遇水发生反应: 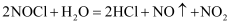 。某化学兴趣小组设计如图装置用
。某化学兴趣小组设计如图装置用  和
和 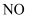 制备
制备 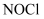 。回答下列相关问题:
。回答下列相关问题: 
-
(1) 甲装置发生反应的离子方程式为,装置丙中的液体是浓硫酸。
-
(2) 实验时,先通入
 ,待丁中烧瓶内充满黄绿色气体时,再通入
,待丁中烧瓶内充满黄绿色气体时,再通入 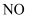 ,这样做的目的是。
,这样做的目的是。
-
(3) 装置丁中冰盐水的作用是。
-
(4) 经分析该套装置设计上有一处明显缺陷,改进方法是。(用文字描述)
-
(5) 吸收尾气时,
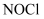 发生反应的化学方程式为。(已知:
发生反应的化学方程式为。(已知:  )
)
-
(6) 反应完成后,取烧瓶中所得产物mg溶于水,配制成
 溶液,取出
溶液,取出 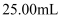 ,再加入
,再加入 

 溶液恰好完全反应,则产物中
溶液恰好完全反应,则产物中  纯度(质量分数)的计算式为。
纯度(质量分数)的计算式为。
下列方程式与所给事实不相符的是( )
A . 向FeBr2溶液中通入过量Cl2:2Fe2++Cl2=2Fe3++2Cl-
B . 实验室制氨气:2NH4Cl+Ca(OH)2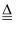 2NH3↑+CaCl2+2H2O
C . 铝溶于NaOH溶液:2Al+2OH-+2H2O=2AlO
2NH3↑+CaCl2+2H2O
C . 铝溶于NaOH溶液:2Al+2OH-+2H2O=2AlO +3H2↑
D . 将充满NO2的试管倒扣在水中:3NO2+H2O=2HNO3+NO
+3H2↑
D . 将充满NO2的试管倒扣在水中:3NO2+H2O=2HNO3+NO
 2NH3↑+CaCl2+2H2O
C . 铝溶于NaOH溶液:2Al+2OH-+2H2O=2AlO
2NH3↑+CaCl2+2H2O
C . 铝溶于NaOH溶液:2Al+2OH-+2H2O=2AlO +3H2↑
D . 将充满NO2的试管倒扣在水中:3NO2+H2O=2HNO3+NO
+3H2↑
D . 将充满NO2的试管倒扣在水中:3NO2+H2O=2HNO3+NO
回答下列问题:
-
(1) 某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图:
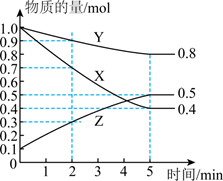
①该反应的化学方程式是。
②2min内X的转化率为。
-
(2) KMnO4是实验室中常用的一种试剂。回答下列问题:
①在酸性高锰酸钾溶液中滴加过量的草酸(H2C2O4弱酸)溶液,振荡,溶液紫色变无色。发生的化学反应为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+1OCO2↑+ 8H2O,若将该反应设计成原电池,则正极反应式为。
②在10mL 0.1 mol/L KMnO4溶液(含稀硫酸)中加入15 mL0.5 mol/L草酸溶液,收集到的CO2的量与时间的关系如图所示。AB段反应速率增大的原因可能是(填字母)。

A.该反应是放热反应 B.反应物浓度增大
C.K2SO4起催化作用 D.MnSO4起催化作用
下列离子方程式书写正确的是( )
A . 过量的铁粉与稀硝酸反应: B . 实验室用氢氧化钙与氯化铵制备氨气:
B . 实验室用氢氧化钙与氯化铵制备氨气: C . 向
C . 向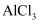 溶液中加入过量的氨水:
溶液中加入过量的氨水: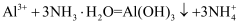 D . 将
D . 将 通入
通入 溶液产生黄色沉淀:
溶液产生黄色沉淀:
 B . 实验室用氢氧化钙与氯化铵制备氨气:
B . 实验室用氢氧化钙与氯化铵制备氨气: C . 向
C . 向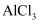 溶液中加入过量的氨水:
溶液中加入过量的氨水: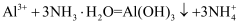 D . 将
D . 将 通入
通入 溶液产生黄色沉淀:
溶液产生黄色沉淀:
利用铜矿石(主要成分为 , 还含少量
, 还含少量 ,
,  , 制备
, 制备 晶体的流程如下图所示。已知
晶体的流程如下图所示。已知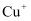 在酸性条件下不稳定,易生成金属
在酸性条件下不稳定,易生成金属 和
和 , 下列说法错误的是( )
, 下列说法错误的是( )
 , 还含少量
, 还含少量 ,
,  , 制备
, 制备 晶体的流程如下图所示。已知
晶体的流程如下图所示。已知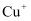 在酸性条件下不稳定,易生成金属
在酸性条件下不稳定,易生成金属 和
和 , 下列说法错误的是( )
, 下列说法错误的是( )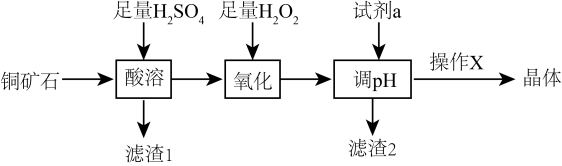
A . “滤渣1”的成分为 、
、 B . “氧化”过程中的离子方程式:
B . “氧化”过程中的离子方程式: C . “调
C . “调 ”所用的试剂a可选用
”所用的试剂a可选用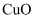 D . 操作X为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D . 操作X为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
 、
、 B . “氧化”过程中的离子方程式:
B . “氧化”过程中的离子方程式: C . “调
C . “调 ”所用的试剂a可选用
”所用的试剂a可选用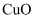 D . 操作X为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D . 操作X为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
下列离子方程式正确的是( )
A . 向 溶液中通入过量
溶液中通入过量 :
: B .
B .  溶液中滴加足量的浓氨水:
溶液中滴加足量的浓氨水: C . 向苯酚溶液中滴加
C . 向苯酚溶液中滴加 溶液:
溶液:


 D . 向氯化亚铁溶液中滴加稀硝酸:
D . 向氯化亚铁溶液中滴加稀硝酸:
 溶液中通入过量
溶液中通入过量 :
: B .
B .  溶液中滴加足量的浓氨水:
溶液中滴加足量的浓氨水: C . 向苯酚溶液中滴加
C . 向苯酚溶液中滴加 溶液:
溶液:

 D . 向氯化亚铁溶液中滴加稀硝酸:
D . 向氯化亚铁溶液中滴加稀硝酸:
最近更新



