离子方程式的书写 知识点题库
 Mn2++2Cl﹣+Cl2↑+2H2O
B . 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
C . Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH﹣+O2↑
D . Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3﹣+Ca2++OH﹣=CaCO3↓+H2O
Mn2++2Cl﹣+Cl2↑+2H2O
B . 明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
C . Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH﹣+O2↑
D . Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3﹣+Ca2++OH﹣=CaCO3↓+H2O
选项 | 离子方程式 | 评价 |
A | 将1mol Cl2通入到含1mol FeI2的溶液中: 2Fe2++2I﹣+2Cl2=2Fe3++4Cl﹣+I2 | 正确;Cl2过量,可将 Fe2+、I﹣均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO3﹣+OH﹣=MgCO3↓+H2O | 正确;酸式盐与碱反应 生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO﹣=HClO+HSO3﹣ | 正确; 说明酸性: H2SO3强于HClO |
D | 1mol/L的NaAl(OH)4溶液和2.5mol/L的HCl溶 液等体积互相均匀混合:2[Al(OH)4]﹣+5H+=Al3++Al(OH)3↓+5H2O | 正确:[Al(OH)4]﹣与Al(OH)3消耗的H+的物 质的量之比为2:3 |
 CH2=CH2↑+NaBr+H2O
C . 丙烯聚合:nCH2=CHCHCH3
CH2=CH2↑+NaBr+H2O
C . 丙烯聚合:nCH2=CHCHCH3  +CO2+H2O→
+CO2+H2O→ -
(1) Ⅰ.工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1反应B:CO2(g)+H2
 H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式:。
-
(2) 反应A可自发进行的温度条件是(填“低温”或“高温”)。
-
(3) 写出两个有利于提高反应A中甲醇平衡产率的条件。
-
(4) 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

①由上图可知,影响产物选择性的外界条件是。
A.温度 B.压强 C.催化剂
②图1中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为(用分数表示)。
-
(5) Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

阳极反应式为。
-
(6) 除去NH4+的离子反应方程式为。
-
(1) 某透明溶液仅含Na+、Fe2+、Ba2+、Al3+、NO3-、Cl-、SO42-中的4种离子,所含离子均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。回答下列问题:
①溶液中存在的离子是;
②写出溶液中加入过量的稀硫酸反应的离子方程式;
-
(2) 以TiO2为催化剂用NaClO将CN-离子氧化成CNO- , CNO-在酸性条件下继续与NaClO反应生成N2、CO2、Cl2等。取浓缩后含CN-离子的废水与过量NaClO溶液的混合液共200mL(设其中CN-的浓度为0.2mol·L-1)进行实验。
①写出CNO-在酸性条件下被NaClO氧化的离子方程式:;
②若结果测得CO2的质量为1.408g,则该实验中测得CN-被处理的百分率为。
-
(3) 酸性KMnO4、H2O2、NaClO在生产、生活、卫生医疗中常用作消毒剂,其中H2O2还可用于漂白,是化学实验室里必备的重要氧化试剂。高锰酸钾造成的污渍可用还原性的草酸 (H2C2O4)去除,Fe(NO3)3也是重要氧化试剂,下面是对这三种氧化剂性质的探究。
①向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,反应的化学方程式。
②取300 mL 0.2 mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3 , 则消耗KMnO4的物质的量的是mol。
③在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色。写出溶液先变为浅绿色的离子方程式:。

回答下列问题:
-
(1) 步骤i中生成VOCl2的同时还产生一种无色无污染的气体,所发生反应的化学方程式为。只用浓盐酸与V2O5反应也能制备VOCl2溶液,从安全与环保角度分析,该反应不被推广的主要原因是。
-
(2) 步骤ii可在下图装置中进行。

①向锥形瓶中滴加VOCl2溶液前应通入一段时间的CO2 , 目的是。
②装置B中的试剂是。
③反应结束后,将锥形瓶置于干燥器中一段时间,可得到紫红色晶体,然后抽滤洗涤,先用饱和NH4HCO3溶液洗涤3次,再用无水乙醇洗涤2次,最后用乙醚洗涤2次。用饱和NH4HCO3溶液洗涤除去的阴离子主要是,用无水乙醇洗涤的目的是。
-
(3) 测定氧钒(IV )碱式碳酸铵晶体粗产品中钒的含量。
称量a g样品于锥形瓶中,用20mL蒸馏水与30mL混酸溶解后,加0.02mol/L KMnO4溶液至稍过量,充分反应后继续加1%NaNO2溶液至稍过量。再用尿素除去过量的NaNO2 , 滴入几滴铁氰化钾{K3[ Fe(CN)6]}溶液,最后用c mol/L(NH4)2Fe(SO4)2标准溶液滴定至终点,消耗体积为b mL。滴定反应为:
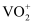 +Fe2++2H+=VO2++Fe3++H2O
+Fe2++2H+=VO2++Fe3++H2O①KMnO4溶液的作用是
②滴定终点时的现象为
③粗产品中钒的质量分数的表达式为

回答下列问题:
-
(1) 盛放浓盐酸的仪器名称是,a中的试剂为。
-
(2) c中采用冰水冷却方式的目的是,c中化学反应的离子方程式是。
-
(3) d的作用是,可选用试剂(填标号)。
A Na2SO3 B NaCl C Ca(OH)2 浊液 D H2SO4
-
(4) 反应结束后,取出b中试管,经冷却结晶,,,干燥,得到KClO3晶体。
-
(5) 取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,滴入少量CCl4溶液显紫色,请写出该反应的离子方程式 。
 B .
B .  与水反应制氧气:
与水反应制氧气:  C . 向硅酸钠溶液中通入少量
C . 向硅酸钠溶液中通入少量  D . 向亚硫酸钠溶液中滴加稀硝酸:
D . 向亚硫酸钠溶液中滴加稀硝酸: 
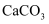 与稀硝酸反应:
与稀硝酸反应:  B . 向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜:
B . 向银氨溶液中滴加乙醛,水浴加热,析出光亮银镜: 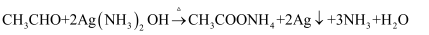 C . 向
C . 向 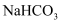 溶液中加入足量石灰水:
溶液中加入足量石灰水:  D . NaOH溶液与过量
D . NaOH溶液与过量  溶液反应:
溶液反应: 
 +Ba2+=Al(OH)3↓+BaSO4↓
C . 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
D . 电解饱和食盐水:2Cl-+2H2O
+Ba2+=Al(OH)3↓+BaSO4↓
C . 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
D . 电解饱和食盐水:2Cl-+2H2O  H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
 , 还含有
, 还含有 、
、 、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
、S、Cu、Pb、Fe等杂质)为原料制备金属锡,其主要工艺流程如下:
查阅资料可知:钨酸钙( )难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
)难溶于水,Sn、Pb在化合物中主要呈现+2、+4两种化合价。
回答下列问题:
-
(1) 氧化焙烧时加快反应速率的方法有(任填一种),气体甲的主要成分是(填化学式)。
-
(2) 在固体1中加入
 溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是(填化学式);固体2中Pb元素的化合价为。
溶液并进行熔烧,其目的是将W元素转化为可溶性盐分离出来,已知该过程中不涉及氧化还原反应,则溶液A中含W元素的溶液的溶质是(填化学式);固体2中Pb元素的化合价为。
-
(3) 固体3通过还原冶炼可得到粗锡,若使用焦炭在高温条件下进行,其反应原理与二氧化硅和碳反应相似,则还原制得锡的化学方程式为。
-
(4)
 具有强还原性,在酸性条件易被空气中的
具有强还原性,在酸性条件易被空气中的 氧化,其反应的离子方程式为。
氧化,其反应的离子方程式为。
-
(5) 通过下列过程可以测定粗锡中锡的纯度:将粗锡样品溶于盐酸中得到
 溶液,再加入过量的
溶液,再加入过量的 溶液转化为
溶液转化为 , 然后用已知浓度的
, 然后用已知浓度的 溶液去滴定生成的
溶液去滴定生成的 。现有粗锡样品0.613g,经上述各步反应后,共用去
。现有粗锡样品0.613g,经上述各步反应后,共用去 溶液16.0mL,则该粗锡样品中锡的质量分数为(假设杂质不参与反应)。
溶液16.0mL,则该粗锡样品中锡的质量分数为(假设杂质不参与反应)。
 B . 电解饱和MgCl2溶液:2Cl-+2H2O
B . 电解饱和MgCl2溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
C . 用Na2S2O3溶液吸收水中的Cl2:4Cl2+
2OH-+H2↑+Cl2↑
C . 用Na2S2O3溶液吸收水中的Cl2:4Cl2+ +5H2O=10H++2
+5H2O=10H++2 +8Cl-
D . 将0.2mol·L-1的NH4Al(SO4)2溶液与0.4mol·L-1的Ba(OH)2溶液等体积混合:2Al3++3
+8Cl-
D . 将0.2mol·L-1的NH4Al(SO4)2溶液与0.4mol·L-1的Ba(OH)2溶液等体积混合:2Al3++3 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓

下列说法错误的是( )
 +H2O
D . Al2O3为离子化合物,其熔点高
+H2O
D . Al2O3为离子化合物,其熔点高
 +CO2=Al(OH)3↓+HCO
+CO2=Al(OH)3↓+HCO B . 向稀硫酸中滴加Na2S2O3溶液:2H++S2O
B . 向稀硫酸中滴加Na2S2O3溶液:2H++S2O =S↓+SO2↑+H2O
C . 向新制氯水中滴加少量FeBr2溶液:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D . 向NH4Cl溶液中加入小颗粒钠:2Na+2H2O=2Na++2OH-+H2↑
=S↓+SO2↑+H2O
C . 向新制氯水中滴加少量FeBr2溶液:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
D . 向NH4Cl溶液中加入小颗粒钠:2Na+2H2O=2Na++2OH-+H2↑

已知:①酸浸后溶液中金属离子有Ni2+、Mn2+、Fe3+;本流程中,Ni2+不被氧化。
②在pH=5时,KMnO4的还原产物为MnO2;
③常温时,Ksp[Fe(OH)3]=1.0×10-39 , Ksp[Mn(OH)2]=4.0×10-14 , 溶液中离子的浓度小于1×10-5认为已除尽;
④Ni2++H2Y2-=[NiY]2-+2H+;紫脲酸胺:紫色试剂,遇Ni2+显橙黄色。
回答下列问题:
-
(1) “碱洗”工序中,加入Na2CO3溶液后应加热煮沸5min,煮沸的目的为。
-
(2) “酸浸”工序中Mn2O3发生反应的化学方程式为。
-
(3) 滤渣I的主要成分为(填化学式),该物质中的金属阳离子在溶液中的残留浓度为mol·L-1。
-
(4) “净化”工序中加入KMnO4溶液时发生反应的离子方程式为。
-
(5) “沉镍”工序中,与选用Na2C2O4溶液相比,选用等浓度的(NH4)2C2O4溶液会大大降低产品中的氢氧化镍杂质含量,原因为。
-
(6) 测定NiC2O4·2H2O产品中镍元素的含量:取2.500g样品,用硫酸溶解后配成250mL溶液,取25.00mL于锥形瓶中进行滴定,滴入几滴紫脲酸胺指示剂,用浓度为0.1000mol/L的Na2H2Y溶液进行滴定,达到滴定终点时消耗Na2H2Y溶液的体积12.50mL。达到滴定终点的实验现象为,NiC2O4·2H2O产品中镍元素的含量为%。
 溶液与
溶液与 溶液反应:
溶液反应: B .
B .  溶液与碘酒反应:
溶液与碘酒反应: C . 亚铬酸钠溶液与过氧化氢反应:
C . 亚铬酸钠溶液与过氧化氢反应: D . 已知:
D . 已知: 、
、 的
的 分别为
分别为 、
、 ,
,  中加入足量澄清石灰水:
中加入足量澄清石灰水:
-
(1) Na、Na2O、Na2O2、NaOH久置空气中最终都变为(填化学式)。
-
(2) 小块金属钠投入水中发生反应的离子方程式为;若4.6g金属钠完全与水反应,可产生标准状况下H2的体积是 L。
-
(3) Na2O、Na2O2都属于 (“碱性氧化物”或“氧化物”),可用蒸馏水检验Na2O中混有少量Na2O2 , 试用化学方程式解释含有Na2O2的现象:。
-
(4) 如图装置可用于鉴别NaHCO3和Na2CO3 , 这是根据它们具有不同的性质加以鉴别。实验中可观察到b中澄清石灰水变浑浊,则物质A为 (填名称)。

-
(5) 1mL0.1mol•L-1NaHCO3溶液与1mL0.01mol•L-1Ca(OH)2溶液混合产生CaCO3白色沉淀。生成CaCO3的反应过程:HCO
 +OH-=CO
+OH-=CO +H2O、Ca2++CO
+H2O、Ca2++CO =CaCO3↓。某同学设计了如下实验方案,验证上述反应过程,请将方案补充完整:
=CaCO3↓。某同学设计了如下实验方案,验证上述反应过程,请将方案补充完整:实验步骤
实验现象
i.取1mL0.1mol•L-1NaHCO3溶液,向其中加入1mL0.01mol•L-1CaCl2溶液
无明显现象
ii.向上述溶液中滴加



