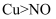氧化性、还原性强弱的比较 知识点题库
化学方程式可简明地体现元素及其化合物的性质.已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl=2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH=2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN+K2CO3=2KSCN+CO2↑+H2O; KCN+CO2+H2O=HCN+KHCO3
热分解反应:4NaClO 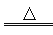 3NaCl+NaClO4;NaClO4
3NaCl+NaClO4;NaClO4 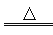 NaCl+2O2↑
NaCl+2O2↑
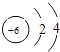 B .
B . 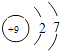 C .
C . 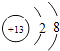
①I2+SO2+2H2O═H2SO4+2HI;
②2FeCl2+Cl2═2FeCl3;
③2FeCl3+2HI═2FeCl2+2HCl+I2 .

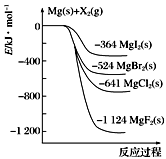
①Mg(s)所具有的能量高于MgX2(s)所具有的能量
②MgCl2电解制Mg(s)和Cl2(g)是吸热过程
③热稳定性:MgI2>MgBr2>MgCl2>MgF2
④常温下氧化性:F2<Cl2<Br2<I2
 B .
B . 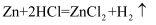 C .
C . 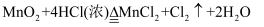 D .
D . 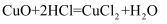
①SO3+H2O=H2SO4 ②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2 ④2Na+2H2O=2NaOH+H2↑
⑤Na2O+2HCl=2NaCl+H2O ⑥SiO2+2NaOH=Na2SiO3+H2O
-
(1) 上述反应中,不属于氧化还原反应的是(填序号,下同)。H2O被氧化的是;H2O被还原的是;属于氧化还原反应,但其中的H2O既不被氧化又不被还原的是。
-
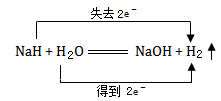
(2) 用双线桥法标出反应②中电子转移的方向和数目: 。
-
(3) 用单线桥法标出反应③中电子转移的方向和数目:。
-
(4) 写出反应⑥的离子方程式: 。
②Fe2(SO4)3+2HI=2FeSO4+I2+ H2SO4
③K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+ K2SO4+7H2O
下列结论错误的是( )
-
(1) 氧化还原反应的实质是。
-
(2) 废钒催化剂回收工艺中涉及的反应为
 。
。已知氯气与亚硫酸根离子会发生反应:
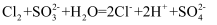 ;根据上述两个反应,可推出
;根据上述两个反应,可推出 、
、 、
、 的还原性由强到弱的顺序为。
的还原性由强到弱的顺序为。 -
(3) 某实验兴趣小组根据氧化还原反应相关知识。探究
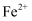 、
、 、
、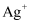 三者的氧化性强弱,设计实验装置如图:
三者的氧化性强弱,设计实验装置如图: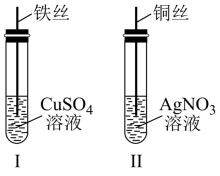
①实验Ⅰ的现象是;实验Ⅱ的现象是。
②实验Ⅱ发生反应的离子方程式为。
③综合实验Ⅰ和实验Ⅱ的现象及氧化还原反应的理论知识,可推测出
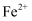 、
、 、
、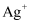 三者的氧化性由强到弱的顺序为。
三者的氧化性由强到弱的顺序为。④当两实验过程中发生的氧化还原反应转移的电子数相同时,铁丝与铜丝增重的质量之比为。(已知:实验起始时,铁丝与铜丝的质量相同且均足量)
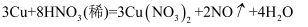 。下列说法错误的是( )
。下列说法错误的是( )
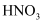 作氧化剂
B . 铜作还原剂
C .
作氧化剂
B . 铜作还原剂
C . 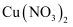 既是氧化产物又是还原产物
D . 还原性:
既是氧化产物又是还原产物
D . 还原性: