氧化性、还原性强弱的比较 知识点题库
已知W2、X2、Y2、Z2四种物质的氧化能力Z2>X2>W2>Y2 , 判断下列氧化还原反应能发生的是( )
A . 2W﹣+Z2→2z﹣+W2
B . 2X﹣+W2→2W﹣+X2
C . 2X﹣+Y2→2Y﹣+X2
D . 2Z﹣+X2→2X﹣+Z2
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断错误的是( )

A . 还原性:HSO3->I- , 氧化性:IO3->I2>SO42-
B . a点处的氧化产物是SO42- , 还原产物是I-
C . 当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol
D . 若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O
已知2KMnO4+16HCl(浓)=2KCl+5Cl2↑+2MnCl2+8H2O,下列说法正确的是( )
A . HCl发生了还原反应
B . 氧化性:Cl2>KMnO4
C . 该反应中浓HCl只体现了还原性
D . 当标准状况下产生22.4L氯气时,转移电子数为2NA
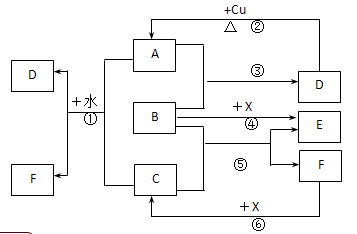
已知A~F是中学化学中常见物质,其中A、C、E为气体,且A能使品红溶液褪色;B、D为液体,D的浓溶液在常温下能使铁钝化;F的浓溶液与X共热通常用于实验室制备单质C;X是一种黑色粉末,B分子中有18个电子。(反应中部分生成物已略去)
-
(1) 写出反应②的化学方程式:。
-
(2) 写出反应①、⑤的离子方程式:①;⑤.
-
(3) 根据图中信息,B、C、D、X氧化性从强到弱的顺序是.
下列说法错误的是( )
A . 离子半径(r): 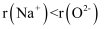 B . 若存在简单阴离子
B . 若存在简单阴离子  ,则X一定属于第ⅦA族元素
C . S和Se属于第ⅥA族元素,H2S的还原性比H2Se的弱
D . 元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素
,则X一定属于第ⅦA族元素
C . S和Se属于第ⅥA族元素,H2S的还原性比H2Se的弱
D . 元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素
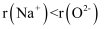 B . 若存在简单阴离子
B . 若存在简单阴离子  ,则X一定属于第ⅦA族元素
C . S和Se属于第ⅥA族元素,H2S的还原性比H2Se的弱
D . 元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素
,则X一定属于第ⅦA族元素
C . S和Se属于第ⅥA族元素,H2S的还原性比H2Se的弱
D . 元素周期表中从第ⅢB族到第ⅡB族10个纵行的元素都是金属元素
下列反应中,氧化剂与还原剂物质的量的关系为1∶2的是( )
A . Fe+2HCl=FeCl2+H2↑
B . 4HCl(浓)+MnO2  MnCl2+Cl2↑+2H2O
C . I2+2NaClO3=2NaIO3+Cl2↑
D . 2HCl+Ca(ClO)2=2HClO+CaCl2
MnCl2+Cl2↑+2H2O
C . I2+2NaClO3=2NaIO3+Cl2↑
D . 2HCl+Ca(ClO)2=2HClO+CaCl2
 MnCl2+Cl2↑+2H2O
C . I2+2NaClO3=2NaIO3+Cl2↑
D . 2HCl+Ca(ClO)2=2HClO+CaCl2
MnCl2+Cl2↑+2H2O
C . I2+2NaClO3=2NaIO3+Cl2↑
D . 2HCl+Ca(ClO)2=2HClO+CaCl2
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析正确的是( )
A . 滴加KI溶液时,转移2mol电子时生成1mol白色沉淀
B . 通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C . 通入SO2时,SO2与I2反应,I2作还原剂
D . 上述实验条件下,物质的氧化性:Cu2+>I2>SO2
我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe + CuSO4 = Cu + FeSO4。下列有关该反应的说法正确的是( )
A . Fe是氧化剂
B . CuSO4 为还原剂
C . Fe被还原
D . CuSO4 发生还原反应
某同学在做实验时引发了镁失火,他立即拿起二氧化碳灭火器欲把火扑灭,却被实验老师及时制止。原因是CO2可以支持镁燃烧发生以下反应:2Mg+CO2  2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
 2MgO+C,下列关于该反应的判断正确的是( )
2MgO+C,下列关于该反应的判断正确的是( )
A . Mg元素化合价由0价升高到+2价,所以MgO是还原产物
B . 由此反应可以判断氧化性Mg>C,还原性CO2>MgO
C . CO2作氧化剂,表现氧化性,发生氧化反应
D . Mg原子失去的电子数目等于C原子得到的电子数目
高炉炼铁中发生的主要反应为:Fe2O3+3CO  2Fe+3CO2 , 下列有关该反应的说法正确的是( )
2Fe+3CO2 , 下列有关该反应的说法正确的是( )
 2Fe+3CO2 , 下列有关该反应的说法正确的是( )
2Fe+3CO2 , 下列有关该反应的说法正确的是( )
A . 反应前后氧元素化合价发生变化
B . CO作还原剂
C . Fe2O3发生氧化反应
D . CO被还原
金属钼是一种优良的催化剂。工业上冶炼钼所涉及的反应有①2MoS2+7O2  2MoO3+4SO2;②H2MoO4
2MoO3+4SO2;②H2MoO4  MoO3+H2O;MoO3+3H2
MoO3+H2O;MoO3+3H2  Mo+3H2O。下列说法错误的是( )
Mo+3H2O。下列说法错误的是( )
 2MoO3+4SO2;②H2MoO4
2MoO3+4SO2;②H2MoO4  MoO3+H2O;MoO3+3H2
MoO3+H2O;MoO3+3H2  Mo+3H2O。下列说法错误的是( )
Mo+3H2O。下列说法错误的是( )
A . 反应①②③都属于氧化还原反应
B . 反应②③生成的水均属于氧化产物
C . 在反应①中Mo和S均被氧化
D . 反应③中,氧化剂为MoO3
下列反应中需加入氧化剂才能进行的是( )
A . Cl2 → Cl-
B . Zn → Zn2+
C . H2O → H2
D . CuO → CuCl2
关于反应 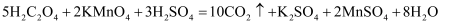 ,下列说法正确的是( )
,下列说法正确的是( )
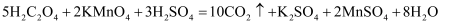 ,下列说法正确的是( )
,下列说法正确的是( )
A .  中C的化合价为
中C的化合价为 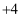 B . 反应中
B . 反应中  和
和  表现氧化性
C . 氧化剂与还原剂的物质的量之为5∶2
D . 氧化产物与还原产物的物质的量之为5∶1
表现氧化性
C . 氧化剂与还原剂的物质的量之为5∶2
D . 氧化产物与还原产物的物质的量之为5∶1
 中C的化合价为
中C的化合价为 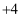 B . 反应中
B . 反应中  和
和  表现氧化性
C . 氧化剂与还原剂的物质的量之为5∶2
D . 氧化产物与还原产物的物质的量之为5∶1
表现氧化性
C . 氧化剂与还原剂的物质的量之为5∶2
D . 氧化产物与还原产物的物质的量之为5∶1
关于反应8NH3+6NO2=7N2+12H2O,下列说法正确的是( )
A . NH3中H元素被氧化
B . NO2在反应过程中失去电子
C . 还原剂与氧化剂的物质的量之比为3:4
D . 氧化产物与还原产物的质量之比为4:3
 因具有杀菌能力强,对人体、动物没有危害以及对环境不造成二次污染等特点,备受人们的青睐。下图是一种制
因具有杀菌能力强,对人体、动物没有危害以及对环境不造成二次污染等特点,备受人们的青睐。下图是一种制  的微观示意图。下列有关说法正确的是( )
的微观示意图。下列有关说法正确的是( ) 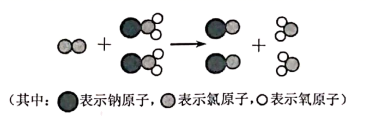
A . 该反应中只有共价键的断裂与形成
B . 该反应中, 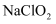 作氧化剂
C . 该条件下,氧化性:
作氧化剂
C . 该条件下,氧化性: 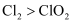 D . 制取
D . 制取 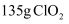 ,有
,有  失去电子
失去电子
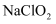 作氧化剂
C . 该条件下,氧化性:
作氧化剂
C . 该条件下,氧化性: 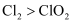 D . 制取
D . 制取 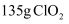 ,有
,有  失去电子
失去电子
-
(1) 储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应式为:C+K2Cr2O7+H2SO4——CO2+K2SO4+Cr2(SO4)3+H2O(未配平)
①配平上述方程式:
②上述反应中氧化剂是(填化学式,下同),氧化产物是。
③H2SO4在上述发应中表现出来的性质是(填序号)
a.氧化性 b.氧化性和酸性 c.酸性 d.还原性和酸性
-
(2) 由下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,请回答下列问题:
①将这6种物质分别填入下面对应的横线上,组成化学方程式并配平:
+ → I2 + + +H2O
②用双线桥表示该反应中电子转移的方向和数目:
铁与不同浓度HNO3反应时的主要还原产物如图所示。下列说法错误的是( )
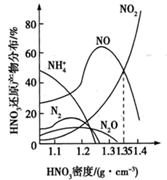
A . 其他条件相同,铁与浓硝酸(1.40g·cm-3)反应的主要还原产物为NO2
B . 硝酸的浓度越小,还原产物中低价态的成分越多
C . 一定量的铁粉与浓硝酸(1.26g·cm-3)反应生成2.24L(标准状况下)气体,则参加反应的n(HNO3)=0.1mol
D . 铁与过量浓硝酸(1.35g·cm-3)反应可表示为4Fe+18HNO3=4Fe(NO3)3+3NO↑+3NO2↑+9H2O
根据下列反应进行判断,下列各微粒氧化能力由强到弱的顺序正确的是( )
①ClO3-+5Cl-+6H+=3Cl2+3H2O ②2FeCl3+2KI=2FeCl2+2KCl+I2 ③2FeCl2+Cl2=2FeCl3
A . ClO3- >Cl2 >I2 >Fe3+
B . Cl2> ClO3- >I2 >Fe3+
C . ClO3- >Cl2 >Fe3+ >I2
D . ClO3- >Fe3+ >Cl2 >I2
由下列实验操作及现象得出的结论正确的是 ( )
选项 | 实验操作 | 现象 | 结论 |
A | 向 | 紫红色退去 |
|
B | 加热某盐与 | 红色石蕊试纸变蓝 | 该盐为铵盐 |
C | 将用硫酸酸化的 | 溶液变黄色 | 氧化性: |
D | 向一定浓度的 | 产生黑色沉淀 |
|
A . A
B . B
C . C
D . D
钒元素在酸性溶液中有多种存在形式,其中 为蓝色,
为蓝色, 为淡黄色,
为淡黄色, 具有较强的氧化性,
具有较强的氧化性,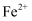 、
、 等能把
等能把 还原为
还原为 。向
。向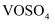 溶液中滴加酸性
溶液中滴加酸性 溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是( )
溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是( )
 为蓝色,
为蓝色, 为淡黄色,
为淡黄色, 具有较强的氧化性,
具有较强的氧化性,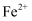 、
、 等能把
等能把 还原为
还原为 。向
。向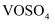 溶液中滴加酸性
溶液中滴加酸性 溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是( )
溶液,溶液颜色由蓝色变为淡黄色。下列说法错误的是( )
A . 在酸性溶液中氧化性: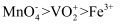 B . 向酸性
B . 向酸性 溶液中加入
溶液中加入 溶液,溶液由淡黄色变为蓝色
C . 向含
溶液,溶液由淡黄色变为蓝色
C . 向含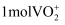 的酸性溶液中滴加含
的酸性溶液中滴加含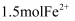 的溶液充分反应,转移电子为
的溶液充分反应,转移电子为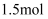 D . 向
D . 向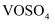 溶液中滴加酸性
溶液中滴加酸性 溶液反应的化学方程式为:
溶液反应的化学方程式为:
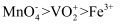 B . 向酸性
B . 向酸性 溶液中加入
溶液中加入 溶液,溶液由淡黄色变为蓝色
C . 向含
溶液,溶液由淡黄色变为蓝色
C . 向含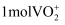 的酸性溶液中滴加含
的酸性溶液中滴加含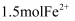 的溶液充分反应,转移电子为
的溶液充分反应,转移电子为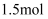 D . 向
D . 向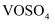 溶液中滴加酸性
溶液中滴加酸性 溶液反应的化学方程式为:
溶液反应的化学方程式为:
最近更新
 中滴加
中滴加 的混合溶液,用湿润的红色石蕊试纸检验产生的气体
的混合溶液,用湿润的红色石蕊试纸检验产生的气体 溶液滴入
溶液滴入 溶液中
溶液中 (酸性条件)
(酸性条件) 溶液中通入适量
溶液中通入适量 气体
气体 强
强


