铝的化学性质 知识点题库
现有一块铝铁合金,欲测定其铝的质量分数,切下W g合金,溶于盐酸中,再加入过量NaOH溶液,滤出沉淀,将沉淀在空气中充分灼烧,最后得到W g红棕色粉末。则此合金中铝的质量分数约为( )
A . 20%
B . 30%
C . 70%
D . 80%
铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的盐酸和氢氧化钠的物质的量之比为
A . 3:1
B . 2:1
C . 1:1
D . 1:3
合金是建造航空母舰的主体材料.如:航母舰体可由合金钢制造,航母升降机可由铝合金制造;航母螺旋桨主要用铜合金制造.
-
(1) Al原子核外电子占据 个纺锤形轨道;Fe原子核外电子排布式为1S22S22P63S23p63d64S2 , 铁原子核外有 种能量不同的电子.
-
(2) 下列事实可用作比较Al和Fe金属性强弱依据的是
A.Al的导电性、导热性比Fe更好
B.Al(OH)3可溶于NaOH溶液,Fe(OH)3不溶于NaOH溶液
C.相同质量的Al片和Fe片,投入到等浓度的稀硫酸溶液中,Al片产生氢气更多
D.在野外利用铝热剂焊接铁轨.
-
(3) 航母在海洋中行驶时,舰体发生的电化学腐蚀类型为: ,其中正极发生的电极反应式为: .
-
(4) 取a克CuAl合金样品用酸完全溶解后,加入过量NaOH,过滤、洗涤、烘干、灼烧得a克固体,则合金中Cu的质量分数为 .
-
(5) Al﹣Mg合金焊接前用NaOH溶液处理铝表面Al2O3膜,其化学方程式为: .
-
(6) 取适量Al、Mg合金样品置于烧杯中,加入20mL 1mol/L的NaOH溶液,恰好完全反应.下列叙述正确的是
A.Mg作负极,Al作正极
B.该反应速率比纯铝与NaOH溶液的反应速率快
C.若把NaOH中的H换成D(D为重氢),生成的氢气中D与H物质的量之比为1:2
D.若加入的是20mL 1mol/L的盐酸,则放出的氢气的物质的量减少
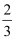 .
.
为了出去铁粉中的少量铝粉,可以选用的试剂是( )
A . 稀盐酸
B . 稀硫酸
C . 氯化铜溶液
D . 氢氧化钠溶液
下列各组中的两种物质作用时,反应条件(温度、反应物用量)改变,不会引起产物种类改变的是( )
A . NaOH和金属铝
B . NaOH 和CO2
C . Na2CO3和HCl
D . Na和O2
下列物质性质与应用对应关系正确的是( )
A . 氨气具有碱性,可用作制冷剂
B . 二氧化硅能与氢氟酸反应,可用于生产光导纤维
C . 铝具有良好导电性和耐腐蚀性,可用于制作高压输电线
D . 二氧化铅具有强氧化性,可用于铅蓄电池的负极材料
铝在人体中积累可使人慢性中毒,世界卫生组织将铝确定为食品污染源之一而加以控制.铝在下列使用场合中,不必要加以控制的是( )
A . 制造炊具
B . 制儿童玩具油漆
C . 制牙膏皮
D . 炼铝厂制造铝锭
下列叙述中正确的是( )
A . 将高温水蒸气通过炽热的铁粉,铁粉变红色
B . 向Fe(OH)3胶体中滴加稀H2SO4 , 先出现沉淀,后沉淀溶解
C . 向FeCl2溶液中加入几滴KSCN溶液,溶液变为血红色,则FeCl2溶液完全变质
D . 铝在空气中耐腐蚀,所以铝是不活泼金属
以下物质间的每步转化通过一步反应就能实现的是( )
A . Al﹣Al2O3﹣Al(OH)3﹣NaAlO2
B . S﹣SO3﹣H2SO4﹣MgSO4
C . Mg﹣MgCl2﹣Mg(OH)2﹣MgO
D . Si﹣SiO2﹣H2SiO3﹣Na2 SiO3
下列有关物质的性质与用途具有对应关系的是( )
A . ClO2具有强氧化性,可用于消毒杀菌
B . 浓硫酸具有脱水性,可用于干燥气体
C . 铝具有良好导热性,可用铝罐贮运浓硝酸
D . FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂
甲、乙两烧杯中各盛有100mL,1.5mol·L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入2.7g的铝粉,反应结束后甲、乙两烧杯中生成气体在相同条件下的体积比是( )
A . 1∶1
B . 1∶2
C . 2∶1
D . 3∶2
既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是( )
①Al ②Al2O3 ③NaHCO3 ④Al(OH)3
A . ③④
B . ②③④
C . ①③④
D . 全部
下列陈述I、II正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | 蛋白质和淀粉都是高分子化合物 | 蛋白质和淀粉水解最终产物均是葡萄糖 |
| B | 汽油和植物油都属于烃 | 汽油和植物油都可以燃烧 |
| C | 盐酸和氨水能溶解Al(OH)3 | Al(OH)3是两性氢氧化物 |
| D | 铝具有还原性 | 铝粉和氧化铁粉末可发生铝热反应 |
A . A
B . B
C . C
D . D
化学与人类生产、生活密切相关,下列有关说法错误的是( )
A . 利用铝热反应焊接铁轨
B . “光化学烟雾”的形成与氮氧化合物有关
C . 用活性炭为糖浆脱色和用SO2漂白纸浆的原理相同
D . 用烧碱处理含高浓度NH4+的废水并回收利用氨
下列反应的离子方程式书写正确的是( )
A . 小苏打溶液中加入醋酸:HCO  +H+=CO2+H2O↑
B . 铁锈溶于稀硫酸:Fe2O3+6H+=2Fe3++3H2O
C . 铝溶于氢氧化钠溶液:Al+OH-+H2O=AlO
+H+=CO2+H2O↑
B . 铁锈溶于稀硫酸:Fe2O3+6H+=2Fe3++3H2O
C . 铝溶于氢氧化钠溶液:Al+OH-+H2O=AlO  +H2↑
D . 0.1mol•L-1的NaAlO2溶液和0.15mol•L-1的H2SO4溶液等体积混合:AlO
+H2↑
D . 0.1mol•L-1的NaAlO2溶液和0.15mol•L-1的H2SO4溶液等体积混合:AlO  +4H+=Al3++2H2O
+4H+=Al3++2H2O
 +H+=CO2+H2O↑
B . 铁锈溶于稀硫酸:Fe2O3+6H+=2Fe3++3H2O
C . 铝溶于氢氧化钠溶液:Al+OH-+H2O=AlO
+H+=CO2+H2O↑
B . 铁锈溶于稀硫酸:Fe2O3+6H+=2Fe3++3H2O
C . 铝溶于氢氧化钠溶液:Al+OH-+H2O=AlO  +H2↑
D . 0.1mol•L-1的NaAlO2溶液和0.15mol•L-1的H2SO4溶液等体积混合:AlO
+H2↑
D . 0.1mol•L-1的NaAlO2溶液和0.15mol•L-1的H2SO4溶液等体积混合:AlO  +4H+=Al3++2H2O
+4H+=Al3++2H2O
五种短周期元素A、B、C、D、E原子序数依次增大。B的最外层电子数是其电子层数的3倍;C、D、E的最高价氧化物对应水化物两两均可反应;A的单质在E的单质中能安静地燃烧,产生苍白色火焰。回答下列问题:
-
(1) B元素在元素周期表中的位置是,B、C、D形成的简单离子的半径由大到小的顺序是(用化学符号表示)。
-
(2) B与C能形成一种淡黄色的固体,其电子式为,它能用于呼吸面具的原因是(用其中一个化学方程式表示)。
-
(3) D的单质常用于焊接钢轨,请用化学方程式表示其反应原理。D、E的最高价氧化物对应水化物之间发生反应的离子方程式为。
化学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )
A . 碳酸钠可用于制作糕点的膨松剂,是因为加热能分解出二氧化碳
B . 电热水器用镁棒防止内胆腐蚀,采用的是牺牲阳极的阴极保护法
C . 含棉、麻、丝、毛及合成纤维的废旧衣物燃烧处理时都只生成CO2和H2O
D . 高纯铝被大量用于制造火箭、导弹和飞机的外壳
下列有关叙述中正确的是( )
A . 碳酸氢钠的电离方程式为NaHCO3=Na++  B . 1 L 1mol/L NaCl溶液与0.5 L 2mol/L NaCl溶液的导电能力相同
C . 单质硅是半导体芯片、光导纤维、太阳能电池的重要成分
D . 铝容易被空气中的氧气氧化不能用作导线
B . 1 L 1mol/L NaCl溶液与0.5 L 2mol/L NaCl溶液的导电能力相同
C . 单质硅是半导体芯片、光导纤维、太阳能电池的重要成分
D . 铝容易被空气中的氧气氧化不能用作导线
 B . 1 L 1mol/L NaCl溶液与0.5 L 2mol/L NaCl溶液的导电能力相同
C . 单质硅是半导体芯片、光导纤维、太阳能电池的重要成分
D . 铝容易被空气中的氧气氧化不能用作导线
B . 1 L 1mol/L NaCl溶液与0.5 L 2mol/L NaCl溶液的导电能力相同
C . 单质硅是半导体芯片、光导纤维、太阳能电池的重要成分
D . 铝容易被空气中的氧气氧化不能用作导线
下列有关反应的离子方程式书写正确的是( )
A . 氯气溶于水: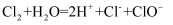 B . Fe溶于足量稀
B . Fe溶于足量稀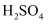 :
: C . 向
C . 向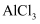 溶液中加入过量浓氨水:
溶液中加入过量浓氨水: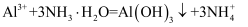 D . 将铝粉与NaOH溶液混合:
D . 将铝粉与NaOH溶液混合: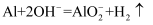
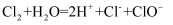 B . Fe溶于足量稀
B . Fe溶于足量稀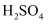 :
: C . 向
C . 向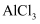 溶液中加入过量浓氨水:
溶液中加入过量浓氨水: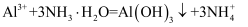 D . 将铝粉与NaOH溶液混合:
D . 将铝粉与NaOH溶液混合: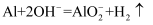
在家务劳动的过程中我们就能体会到化学知识无处不在。下列家务劳动与所涉及的化学知识不相符的是( )
选项 | 家务劳动 | 化学知识 |
A | 用白醋除去水壶中的水垢 | 白醋可溶解碳酸钙等沉淀 |
B | 用含NaClO的84消毒液拖地 | NaClO具有还原性 |
C | 用小苏打粉作膨松剂焙制糕点 | 碳酸氢钠受热容易分解产生气体 |
D | 用铝制锅烧水、煮饭 | 铝表面覆盖着耐高温的致密氧化铝的保护膜 |
A . A
B . B
C . C
D . D
最近更新



