铝的化学性质 知识点题库
在给定条件下,下列加点的物质在化学反应中完全消耗的是
A . 向100mL 3 mol·L-1的硝酸中加入5.6g铁
B . 用50mL 12 mol·L-1的氯化氢水溶液与足量二氧化锰共热制取氯气
C . 将1g铝片投入20mL 18.4 mol·L-1的硫酸中
D . 常温常压下,0.1mol氯气通入1L水中反应
以下物质间的每步转化,不能通过一步反应实现的是( )
A . S→SO2→H2SO4→MgSO4
B . Si→SiO2→Na2SiO3→H2SiO3
C . Al→Al2O3→Al(OH)3→NaAlO2
D . N2→NO→NO2→HNO3
称取两份铝粉,第一份加足量的NaOH溶液,第二份加足量的盐酸,若放出等量的气体,则两份铝粉的质量比( )
A . 1:2
B . 1:3
C . 2:3
D . 1:1
相同质量的铝分别与足量的盐酸和氢氧化钠溶液反应,产生气体的体积比是(相同条件下)( )
A . 1:1
B . 2:3
C . 3:2
D . 1:2
根据要求完成下列化学方程式或离子方程式
-
(1) 金属铝与氢氧化钠溶液反应
-
(2) 工业用焦炭与二氧化硅制粗硅
-
(3) 金属铝与氧化铁的铝热反应
-
(4) Na2O2与水反应的离子方程式
-
(5) 氯化亚铁溶液与氯气反应的离子方程式.
简要回答下列问题.
-
(1) 铝制器具不宜存放酸、碱溶液的原因是.
-
(2) 实验室常用35%~40%的甲醛溶液(俗称福尔马林)保存动物标本的原因是
-
(3) 可降解塑料在环境中可以降解为小分子物质或被微生物分解.研制生产可降解塑料的目的是.
一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L的气体。该合金中铝、铁的物质的量之比为( )
A . 1∶1
B . 2∶5
C . 3∶2
D . 3∶5
向m g镁和铝的混合物中加入适量的稀硫酸,恰好完全反应生成标准状况下的气体b L。向反应后的溶液中加入c mol/L氢氧化钾溶液V mL,使金属离子刚好沉淀完全,得到的沉淀质量为n g。再将得到的沉淀灼烧至质量不再改变为止,得到固体p g。则下列关系不正确的是( )
A . n=17Vc+m
B . 5m/3<p<17m/9
C . p=m+cV/125
D . c=1000b/11.2V
KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐( 主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
![]()
-
(1) 请写出镓(与铝同主族的第四周期元素)的原子结构示意图。
-
(2) 为尽量少引入杂质,试剂①应选用(填标号)。理由是。
A.HCl溶液
B.H2SO4 溶液
C.氨水
D.NaOH溶液
-
(3) 沉淀B的化学式为;将少量明矾溶于水,溶液呈弱酸性,其原因是(用离子方程式表示)。
-
(4) 科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为。
-
(5) 常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者的108倍,则两种溶液的pH=。
-
(6) 已知室温下,Kw=10×10-14 , Al(OH)3
 AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于。
AlO2-+H++H2O K=2.0×10-13。Al(OH)3溶于NaOH溶液反应的平衡常数等于。
下列实验现象描述正确的是( )
| 选项 | 实验 | 现象 |
| A | 向饱和Na2CO3溶液中通入足量的CO2气体 | 无明显现象 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝滴落下来 |
| C | 向Al2(SO4)3溶液中滴加过量NaOH溶液 | 产生大量白色沉淀 |
| D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
A . A
B . B
C . C
D . D
若在加入铝粉能放出H2的溶液中,分别加入下列各组离子,肯定不能共存的是( )
A . Fe3+、NO3-、Cl-、Na+
B . Ba2+、Mg2+、HCO3-、AlO2-
C . NO3-、Na+、K+、CO32-
D . NO3-、K+、SO42-、Cl-
下图是中学化学中常见物质的转化关系,部分物质和反应条件略去。
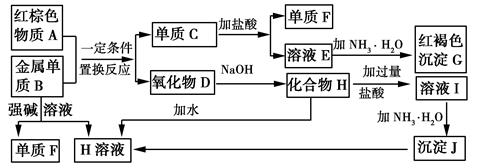
请回答下列问题:
-
(1) 物质A的化学式为。
-
(2) 写出单质B与强碱溶液反应的离子方程式,氧化物D与NaOH溶液反应的化学方程式。
-
(3) 溶液E中加入氨水时,先生成白色沉淀L,L最终变为红褐色沉淀G,写出L变为G的化学反应方程式。
-
(4) 溶液E敞口放置容易变质,写出检验溶液E是否变质的实验操作、现象及结论,为了防止溶液E的变质,可往溶液中加入。
-
(5) 溶液I中所含金属离子是。
表面有氧化膜的铝片,投入到足量的NaOH溶液中,充分反应( )
A . n(还原剂):n(氧化剂)=1:3
B . Al(OH)3表现了弱碱性
C . 氧化剂是NaOH
D . n(生成AlO2-):n(生成H2)=2:3
以废旧磷酸亚铁锂正极材料(主要成分为LiFePO4 , 含炭黑、铝等杂质)为原料可制备LiOH溶液和FePO4。
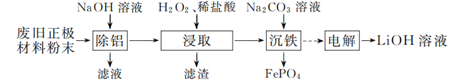
-
(1) “除铝”时反应的离子方程式为。
-
(2) 试从沉淀溶解平衡移动的角度解释“浸取时加入H2O2、稀盐酸”可促进LiFePO4溶解的原因:。
-
(3) “浸取”所得滤液中,磷元素的存在形式主要是(填字母)。
a. PO
 b. H3PO4 c. H2PO
b. H3PO4 c. H2PO 
-
(4) “沉铁”时铁、磷的沉淀率随溶液pH的变化如图1所示。pH>2.5后磷元素的沉淀率逐渐下降,原因是。
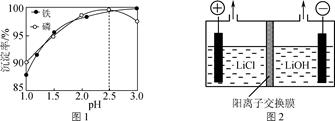
-
(5) “电解”制备LiOH的原理如图2所示,装置中使用阳离子交换膜将电解槽隔成阳极室和阴极室的目的是。
-
(6) LiOH和(NH4)2Fe(SO4)2、H3PO4反应得到LiFePO4、NH4HSO4。写出该反应的化学方程式:。
关于铝热反应,下列描述正确的是( )
A . 铝热剂可以是Fe和Al2O3
B . 可溶于氨水
C . 反应放出大量热
D . 属于非氧化还原反应
A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
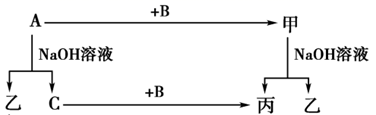
根据图示转化关系回答:
-
(1) 写出下列物质的化学式:A,B,
-
(2) 写出下列变化的方程式:
A与NaOH溶液反应的化学方程式
甲与NaOH溶液反应的离子方程式。
-
(3) 将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为3.36 L,则消耗的A的物质的量为,转移电子的物质的量为。
某研究小组为了研究不同条件下金属铝粉在过量稀硫酸中的溶解性能,设计如下实验。已知:c(H2SO4)=4.5 mol·L-1 , 反应均需要搅拌60 min。
|
编 号 |
温度 /℃ |
加入某盐 |
H2SO4 体积/ml |
H2O 体积 /ml |
铝粉 加入量/g |
铝粉 溶解量/g |
|
① |
20 |
不加 |
40 |
0 |
2.0050 |
0.0307 |
|
② |
80 |
不加 |
40 |
0 |
2.0050 |
0.1184 |
|
③ |
t1 |
不加 |
20 |
V1 |
2.0050 |
/ |
|
④ |
t2 |
5ml 0.01 mol·L-1 CuSO4溶液 |
20 |
V2 |
2.0050 |
/ |
-
(1) 实验①和②的目的是
为了获得铝粉溶解量,还需要测量的数据是。
-
(2) 实验①和③是为了研究硫酸的浓度对该反应的影响,则t1=℃.
-
(3) 实验③和④是为了研究加入CuSO4溶液对该反应的影响,则 V2=mL.
研究表明,在相同条件下加入少量CuSO4有利于Al的溶解。原因是。
-
(4) 纯铝与稀硫酸反应生成氢气的速率—时间图像如图所示:
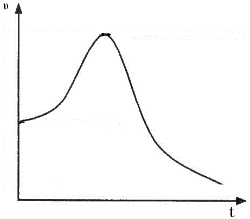
其原因为
下列各组物质的转化不能通过一步反应直接完成的是( )
A .  B .
B . 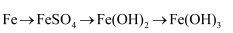 C .
C . 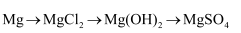 D .
D . 
 B .
B . 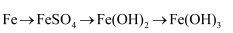 C .
C . 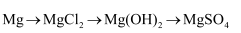 D .
D . 
下列物质的性质和用途均正确且具有因果关系的是( )
A . 单质硫具有可燃性,可用于焰色试验
B . 氢气具有可燃性,可用于金属冶炼
C . 铝丝具有还原性,可用作电缆材料
D . 铁粉具有还原性,可用作食品的抗氧化剂
有些物质既能够与强酸溶液反应,又能够与强碱溶液反应.下列物质不符合的是( )
A . 氧化铝
B . 氯化铝
C . 氢氧化铝
D . 碳酸氢钠
最近更新



