铜及其化合物 知识点题库
铜绿的主要成分[Cu2(OH)2CO3]
-
(1) 写出Cu2(OH)2CO3与稀盐酸反应的离子方程式铜的性质不活泼,所以使用铜器比较安全,但不慎摄入铜盐会导致中毒,原因是
-
(2) Cu2(OH)2CO3可写为Cu2(OH)2•CuCO3 , 写出Cu2(OH)2CO3高温分解的化学方程式
写出Cu2(OH)2CO3与CO高温反应的化学方程式.
-
(3) ag铜绿与足量的CO 高温反应,使生成的气体通入足量的澄清石灰水得到bg白色沉淀,求Cu2(OH)2CO3的纯度.
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答问题:
-
(1) 稀盐酸不与Cu反应,若在稀盐酸中加入H2O2后,则可使铜顺利溶解.该反应的化学方程式为:.
-
(2) 在一定体积的10mol/L的浓硫酸中加入过量铜片.加热使之反应,被还原的硫酸为0.9mol.
则浓硫酸的实际体积(填“大于“、“等于”或“小于”) 180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为.
-
(3) 镁铁混合物4.8g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24LNO气体.若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是克.
含有CO、N2、H2、CO2和少量水蒸气的混合气体,依次通过足量的灼热氧化铜、浓氢氧化钠溶液、浓硫酸后,剩余的气体是( )
A . N2
B . N2和H2
C . N2和CO2
D . H2和CO
某化学兴趣小组利用工厂的铁和铜混合屑末,进行如下实验:

-
(1) 操作X的名称是;
-
(2) 气体D是;
-
(3) A与氧化铜加热反应生成铜和水,反应中固体的颜色变化是;A作(填“氧化剂”或“还原剂”);
-
(4) 溶液B中的金属阳离子是,溶液E中阴离子除了OH﹣外还有.
《唐本草》记载:……本来绿色,新出窟未见风者,正如璃璃。陶及今人谓之石胆,烧之赤色,故名绛矾矣”。文中“绛矾”为( )
A . FeSO4·7H2O
B . CuSO4·5H2O
C . Na2SO4·10H2O
D . KAl(SO4)2·12H2O
在给定条件下,下列物质间转化均能实现的是( )
A . S  SO3
SO3  H2SO4
B . 粗硅
H2SO4
B . 粗硅  SiCl4
SiCl4  Si
C . NH3
Si
C . NH3 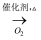 NO
NO  HNO3
D . Cu
HNO3
D . Cu  CuS
CuS 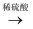 H2S
H2S
 SO3
SO3  H2SO4
B . 粗硅
H2SO4
B . 粗硅  SiCl4
SiCl4  Si
C . NH3
Si
C . NH3 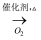 NO
NO  HNO3
D . Cu
HNO3
D . Cu  CuS
CuS 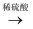 H2S
H2S
部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如图处理:
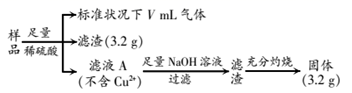
-
(1) 滤渣成分为,滤液A中含有的阳离子为。
-
(2) 样品中铁元素的质量分数为。
下列说法错误的是( )
A . 钠在空气中燃烧时,先熔化,再燃烧,发出黄色火焰,生成过氧化钠
B . 青铜是我国使用最早的合金,钢是用量最大、用途最广的合金
C . 铝是地壳里含量最多的金属元素,在常温下,铝不能与氧气反应
D . 铁在潮湿的空气中生成的氧化物疏松多孔,不能保护内层金属
以下说法正确的是( )
A . 1molCl2和足量Fe反应生成FeCl3转移电子数为3NA
B . Fe与稀HNO3反应,无论生成Fe(NO3)3、Fe(NO3)2 , 还是二者的混合物,被还原的HNO3总是占参与反应的HNO3的 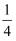 C . 将水蒸气通过灼热的铁粉,铁与水在高温下反应粉末变红
D . 将一定量的铁、铜的混合物加入100mL0.1mol·L-1的FeCl3溶液中,充分反应后溶液中有固体剩余,则剩余的固体中可能含有铜,也可能含有铁
C . 将水蒸气通过灼热的铁粉,铁与水在高温下反应粉末变红
D . 将一定量的铁、铜的混合物加入100mL0.1mol·L-1的FeCl3溶液中,充分反应后溶液中有固体剩余,则剩余的固体中可能含有铜,也可能含有铁
 C . 将水蒸气通过灼热的铁粉,铁与水在高温下反应粉末变红
D . 将一定量的铁、铜的混合物加入100mL0.1mol·L-1的FeCl3溶液中,充分反应后溶液中有固体剩余,则剩余的固体中可能含有铜,也可能含有铁
C . 将水蒸气通过灼热的铁粉,铁与水在高温下反应粉末变红
D . 将一定量的铁、铜的混合物加入100mL0.1mol·L-1的FeCl3溶液中,充分反应后溶液中有固体剩余,则剩余的固体中可能含有铜,也可能含有铁
某教师在课堂上用下图所示的装置来验证浓硫酸与铜是否发生反应并探讨反应所产生气体的性质。Cu+2H2SO4(浓)  CuSO4+SO2↑+2X
CuSO4+SO2↑+2X
 CuSO4+SO2↑+2X
CuSO4+SO2↑+2X 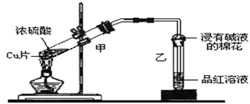
请回答下列问题:
-
(1) 通过试管乙中发生的现象,说明了铜和浓硫酸发生了化学反应,并且该现象还能说明产生的气体具有性。
-
(2) 若要收集试管甲中生成的气体,可以采用方法收集(填序号)。
①排水取气法 ②向上排空气取气法 ③向下排空气取气法
-
(3) 补充试管甲中所发生反应的化学反应方程式中X物质(填分子式)。
-
(4) 试管乙口部浸有碱液的棉花的作用是,此防范措施也说明产生的气体是气体(填“酸性”、“中性”或“碱性”),(填“有”或“无”)毒性。
下列说法错误的是( )
A . 胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间
B . 工业上用二氧化硅在高温下与焦炭反应不可直接制得高纯度的硅
C . CuBr2溶液分别可以与氯水、氨水、AgNO3溶液、铁粉等发生反应
D . 向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度
下列说法错误的是( )
A . 制备铜氨纤维时,取出稀盐酸中的生成物,用水洗涤,得到蓝色的铜氨纤维
B . 天然气的主要成分是甲烷,不同地区天然气中甲烷含量不同
C . 长久存放的氯水逐渐转变为很稀的盐酸
D . 在燃烧木柴时,将木材架空,木材会燃烧的更旺
某同学进行有关铜、硝酸、硫酸化学性质的实验,实验过程如图所示:
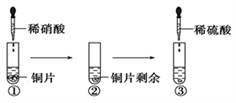
下列说法正确的是( )
A . ①中溶液呈蓝色,试管口有红棕色气体产生,稀硝酸被还原为NO2
B . ②中溶液存在:c(Cu2+) + c(H+) = c(NO3-) + c(OH-)
C . 由上述实验得出结论:常温下,Cu既可与稀硝酸反应,也可与稀硫酸反应
D . ③中反应的化学方程式:3Cu+Cu(NO3)2+4H2SO4 = 4CuSO4 +2NO↑+4H2O
根据下列实验操作和现象所得的结论正确的是( )
| 选项 | 实验操作和现象 | 结论 |
| A | 浓硝酸久置于空气,颜色略显黄色 | 浓硝酸具有不稳定性 |
| B | 铜丝伸入到稀硝酸中,溶液变蓝,有气泡产生 | Cu与稀硝酸发生置换反应 |
| C | 向蔗糖中滴入浓硫酸,固体变黑膨胀 | 浓硫酸具有吸水性 |
| D | SO2通入含有酚酞的氢氧化钠溶液,溶液褪色 | SO2具有漂白性 |
A . A
B . B
C . C
D . D
某化学兴趣小组进行了有关Cu、硝酸、硫酸化学性质的实验,实验过程如图所示。下列有关说法正确的是( )
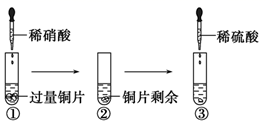
A . 实验①中试管口有红棕色气体产生,说明稀硝酸被Cu还原为NO2
B . 实验③中滴加稀硫酸,铜片继续溶解,说明稀硫酸的氧化性比稀硝酸强
C . 由上述实验可得出结论:Cu在常温下既可以与稀硝酸反应,也可以与稀硫酸反应
D . 实验③发生反应的化学方程式为:3Cu+Cu(NO3)2+4H2SO4 =4CuSO4+2NO↑+4H2O
一定量的浓硝酸与过量的铜粉反应,生成的气体有( )
A . N2
B . NO
C . NO2
D . NH3
向10mL浓度均为3mol•L-1的HNO3与H2SO4的混合溶液中加入1.92g铜,充分反应后,设溶液体积仍为10mL,则产生的气体在标准状况下的体积为( )
A . 0.448L
B . 0.224L
C . 0.336L
D . 无法求解
印刷电路板废液主要含 、
、 以及少量的
以及少量的 等物质,以废液为原料制备
等物质,以废液为原料制备 , 实现资源回收再利用,流程如图所示。
, 实现资源回收再利用,流程如图所示。
 、
、 以及少量的
以及少量的 等物质,以废液为原料制备
等物质,以废液为原料制备 , 实现资源回收再利用,流程如图所示。
, 实现资源回收再利用,流程如图所示。
-
(1) 粗
 溶液的制备
溶液的制备
①上述流程中能加快反应速率的措施有
②加人铁屑后,印刷电路板废液中发生的离子反应有
-
(2)
 溶液的精制
溶液的精制i.经检验,粗
 溶液含有
溶液含有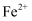
ii.向粗
 溶液滴加3%的
溶液滴加3%的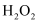 溶液,当溶液中
溶液,当溶液中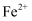 完全氧化后,加
完全氧化后,加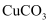 粉末调节溶液的
粉末调节溶液的 ,
, ⅲ.将溶液加热至沸,趁热减压过滤,得到精制
 溶液。
溶液。①用离子方程式说明加入
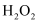 溶液的作用
溶液的作用②已知25℃时,
 ,
,  。调节溶液
。调节溶液 , 此时
, 此时
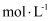 ,
, 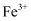 已沉淀完全。
已沉淀完全。③
 时判断
时判断 尚未开始沉淀,根据是(已知25℃时
尚未开始沉淀,根据是(已知25℃时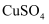 饱和溶液中
饱和溶液中 的物质的量浓度为
的物质的量浓度为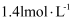 )
) -
(3) 制备
 晶体
晶体向精制的
 溶液中加一定量硫酸,加热蒸发,再冷却至品体析出,过滤得到
溶液中加一定量硫酸,加热蒸发,再冷却至品体析出,过滤得到 晶体。运用化学平衡原理简述硫酸的作用
晶体。运用化学平衡原理简述硫酸的作用
青铜器在古时被称为“金”或“吉金”,是红铜与锡、铅等的合金。铜锈大多呈青绿色,主要含有Cu2(OH)3Cl和Cu2(OH)2CO3。下列说法错误的是( )
A . 青铜器中锡、铅对铜有保护作用
B . 青铜的熔点低于纯铜
C . 可用FeCl3溶液清除青铜器的铜锈
D . 古时冶炼铸造青铜器涉及化学变化
下列说法错误的是( )
A . 将盛有苯酚与水形成的浊液的试管浸泡在80℃热水中一段时间,浊液变澄清
B . pH计、酚酞、甲基橙均可用于氢氧化钠溶液滴定盐酸的终点判断
C . 饱和氯化钠溶液中加入浓盐酸,有白色沉淀析出
D . 硫酸铜溶液中加入过量氨水,溶液变深蓝色,再加入乙醇,溶液无任何变化
最近更新



