铜及其化合物 知识点题库
部分氧化的Fe﹣Cu合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如下处理:下列说法正确的是( )


①NaNO3②KCl③ZnSO4④Fe2(SO4)3 .
①Cu位于元素周期表第ⅠB族.Cu2+的核外电子排布式为.
②Cu2O的熔点比Cu2S的(填“高”或“低”),请解释原因.
-
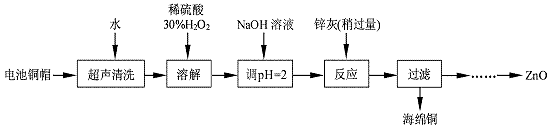
(1) 写出铜帽溶解时铜与加入的稀硫酸、30%H2O2反应的离子反应方程式:;铜帽溶解完全后,需加热(至沸)将溶液中过量的H2O2除去。
-
(2) 为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2 后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2 2S2O32-+I2=2I-+S4O62-
①滴定选用的指示剂为,滴定终点观察到的现象为;
②某同学称取1.0g电池铜帽进行实验,得到100.00mL含有Cu2+的溶液,量取20.00mL上述含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用0.1000mol/L Na2S2O3标准溶液滴定至终点。再重复操作实验3次,记录数据如下:
实验编号
1
2
3
4
V(Na2S2O3)(mL)
28.32
25.31
25.30
25.32
计算电池铜帽中Cu的质量分数为,(结果保留四位有效数字)若滴定前溶液中的H2O2没有除尽,则所测定c (Cu2+)将会(填“偏高”、“偏低”或“无影响”);
-
(3) 常温下,若向50mL 0.0001mol/L CuSO4溶液中加入50mL0.00022mol/LNaOH溶液,生成了沉淀。已知KSP[Cu (OH)2] =2.0×10-20(mol/L)3 , 计算沉淀生成后溶液中c(Cu2+)= mol/L;
-
(4) 已知pH>11 时Zn(OH)2 能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0 mol·L-1计算)。
开始沉淀的pH
沉淀完全的pH
Fe3+
1.1
3.2
Fe2+
5.8
8.8
Zn2+
5.9
8.9
实验中可选用的试剂:30%H2O2、1.0 mol·L-1HNO3、1.0 mol·L-1NaOH。由除去铜的滤液制备ZnO的实验步骤依次为:①向滤液中加入适量30% H2O2 , 使其充分反应;
②;③过滤;
④;⑤过滤、洗涤、干燥;⑥900℃煅烧。

-
(1) 我国最早使用的合金是;
-
(2) Cu、Fe、Na、Al四种金属元素中,金属性最强的是(填元素符号);
Al的原子结构示意图是;
-
(3) 我国西汉时期就开始冶炼铜,古人有“曾青得铁则化为铜”的记载,是现代“湿法炼铜”的先驱,请写出上述反应的化学方程式:;
-
(4) 19世纪初,钠和铝的发现得益于电解技术的应用。
冶炼铝的原料Al2O3属于氧化物(选填“酸性”、“碱性”或“两性”);冶炼铝的反应为:2 Al2O3(熔融)
 4Al +3O2↑ ,反应中生成1molAl转移电子mol。
4Al +3O2↑ ,反应中生成1molAl转移电子mol。
-
(1) Ⅰ.Cu(NO3)2 的氧化性
将光亮的铁丝伸入Cu(NO3)2 溶液中,一段时间后将铁丝取出。为检验溶液中Fe 的氧化产物,将溶液中的Cu2+除尽后,进行了如下实验。可选用的试剂KSCN 溶液、K3[Fe(CN)6]溶液、氯水。
请完成下表:
操作
反应或现象
结论
取少量除尽Cu2+后的溶液于试管中,加入溶液,振荡
现象
存在Fe3+
取少量除尽 Cu2+后的溶液于试管中,加入 K3[Fe(CN)6]溶液,振荡
离子方程式
存在Fe2+
-
(2) Ⅱ.Cu(NO3)2 的热稳定性
在如图所示的实验装置A 中,用酒精喷灯对Cu(NO3)2 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为O2。当反应结束以后,试管中残留固体为红色。
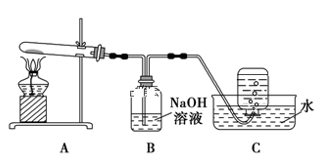

①装置B 的作用是 。
②从实验安全角度考虑,需要在A、B 间加入装置M,请在方框中画出M 装置。
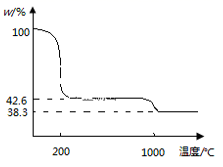
③下图为Cu(NO3)2 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。Cu(NO3)2 加热到200℃的化学方程式为 ,继续高温至1000℃生成(填化学式)固体。
 。
。
 B .
B .  C .
C .  D .
D . 
| 选项 | 实验操作和现象 | 结论 |
| A | 向一定浓度CuSO4溶液中通入H2S气体,出现黑色沉淀 | H2S酸性比H2SO4强 |
| B | 向2mL2%CuSO4溶液中加入几滴1%NaOH溶液,振荡后加入几滴有机物X溶液,加热未出现砖红色沉淀 | X不可能是葡萄糖 |
| C | 常温下,相同铝片分别投入足量稀、浓硫酸中 | 反应物浓度越大,反应速率越大 |
| D | 取5mL0.1mol·L-1KI溶液,加入1mL0.1mol·L-1FeCl3溶液,萃取分液后,向水层滴入KSCN溶液,溶液变成血红色 | Fe3+与I-所发生的反应为可逆反应 |
-
(1) 若A是铁,B是稀硝酸(过量),且A可溶于C溶液中。则铜与C反应的离子方式为。
-
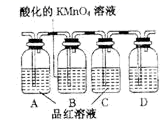
(2) 若C、D均为气体,且都能使澄清石灰水变浑浊,某探究性学习小组利用图中所列装置设计实验,若证明上述反应中有C、D生成。则B瓶溶液的作用是,装置D中所盛溶液是。
-
(3) 若C是无色有刺激性气味的气体,其水溶液呈弱碱性。用电离方程式解释其水溶液呈弱碱性的原因。
-
(4) 若A为黄绿色有刺激性气味的有毒气体,C、D焰色反应为黄色,则上述的反应的离子方程式为。A气体能使湿润的石蕊试纸(填写现象)
-
(5) 若A为铜,C能使品红溶液褪色,则上述的反应的化学方程式为。

实验目的 | 方案设计 | 现象和结论 | |
A | 检验火柴头上氯元素的存在 | 摘下几根火柴头,将火柴头浸于水中,片刻后取少量溶液于试管中,加入稀 | 若产生白色沉淀,说明火柴头上含有氯元素 |
B | 检验 | 取少量固体于试管中,加足量的硫酸铜溶液充分反应,过滤,取滤渣用稀硫酸溶解,将溶液分成两份:一份滴加几滴 | 若前者溶液变血红色,后者溶液紫色褪去,则固体中铁元素有 |
C | 检验淀粉水解程度 | 淀粉溶液中加入稀硫酸,加热,冷却后再加入碘水 | 向若溶液不变蓝,说明淀粉已完全水解 |
D | 探究 |
| 未加 |
 。它们之间的转化关系如下(部分反应物、生成物和反应条件已省略)。
。它们之间的转化关系如下(部分反应物、生成物和反应条件已省略)。
请回答下列问题:
-
(1) A的化学式是。
-
(2) A→C的反应现象是。
-
(3) C→D的离子方程式是。
-
(4) A→E的化学方程式是。
-
(5) E的水溶液可以与反应生成C。

 中含有σ键的数目为16mol
B . 如图所示的
中含有σ键的数目为16mol
B . 如图所示的 晶胞中Cu原子的配位数为4
C .
晶胞中Cu原子的配位数为4
C .  刻蚀Cu制印刷电路板,说明还原性Cu大于Fe
D . 除去Cu粉中混有CuO的方法是加入稀硝酸溶解,过滤、洗涤、干燥
刻蚀Cu制印刷电路板,说明还原性Cu大于Fe
D . 除去Cu粉中混有CuO的方法是加入稀硝酸溶解,过滤、洗涤、干燥
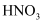 酸化的
酸化的 溶液,充分振荡
溶液,充分振荡 粉中是否含有
粉中是否含有
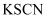 溶液,另一份滴加少量
溶液,另一份滴加少量 溶液
溶液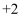 、
、 两种价态,说明固体中含有
两种价态,说明固体中含有 与
与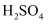 的反应
的反应 固体
固体


