常见金属元素的单质及其化合物的综合应用 知识点题库
Ⅰ为检验市售煤油中是否掺有水,可向煤油样品中加少许白色粉末 (填试剂化学式),
若观察到 现象,就说明煤油中掺有水;也可向煤油样品中加入一小块金属钠,若观察到 现象,就可说明煤油中掺有水,反应的化学方程式是 .
Ⅱ镁着火不能用二氧化碳来灭火,理由是 (用化学方程式表示);
Ⅲ铝是应用最广泛的金属之一,铝的化合物在生产和生活中也有许多用途.
(1)铝离子的结构示意图是 .
(2)铝是一种既能与酸反应又能与碱反应的金属,请写出铝与氢氧化钠溶液反应的化学方程式:
.
(3)将7.8g过氧化钠投入500ml1mol•L﹣1氯化铝溶液中,可观察到的现象是( )
A.放出无色无味的气体,生成大量白色沉淀
B.放出无色无味的气体,生成白色沉淀后恰好溶解
C.放出无色无味的气体,生成白色沉淀后部分溶解
C.放出无色无味的气体,生成白色沉淀后部分溶解.
 SiCl4
SiCl4  Si
B . N2
Si
B . N2  NH3
NH3  NH4Cl(aq)
C . FeS2
NH4Cl(aq)
C . FeS2  SO3
SO3  H2SO4
D . MgCO3
H2SO4
D . MgCO3  MgCl2(aq)
MgCl2(aq)  Mg
Mg
-
(1) 古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
-
(2)
硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):
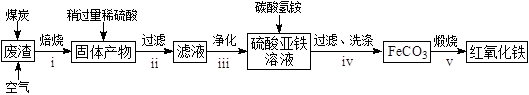
回答下列问题:
①在步骤i中产生的有毒气体可能有。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10−32 , 此时理论上将Al3+沉淀完全,则溶液的pH为。
③步骤iv中,生成FeCO3的离子方程式是。
-
(3) 氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释。
-
(4)
①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN− , 方案如下:
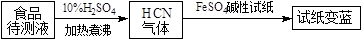
若试纸变蓝则证明食品中含有CN− , 请解释检测时试纸中FeSO4的作用。
①在人类对金属材料的使用过程中,性质活泼的金属单质最早被人们冶炼和使用 ②纯铁比生铁抗腐蚀性更强
③透闪石的化学成分为Ca2Mg5Si8O22(OH)2写成氧化物的形式为:5MgO•2CaO•8SiO2•H2O
④二氧化硅晶体中不存在二氧化硅分子
⑤青铜、不锈钢、硬铝都是合金
⑥光导纤维传递光信号的基本物理原理是光的全反射,其主要原料是SiO2
⑦硅酸钠溶液的俗名是水玻璃,常用作木材的阻燃剂
⑧铝粉和氧化镁粉末混合,高温能发生铝热反应
⑨灼烧某物质时,用眼直接观察到火焰呈黄色,则可判断该物质不含钾元素
⑩称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液.则放出氢气的体积(同温同压下)不相等.

已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq)  PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8 , Ksp(PbCl2)=1.6×10-5。
-
(1) “浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
-
(2) “调pH”的目的是。
-
(3) “沉降”操作时加入冰水的作用是。
-
(4)
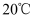 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。  A . 盐酸浓度越小,Ksp(PbCl2)越小 B . x、y两点对应的溶液中c(Pb2+)不相等 C . 当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小 D . 当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
A . 盐酸浓度越小,Ksp(PbCl2)越小 B . x、y两点对应的溶液中c(Pb2+)不相等 C . 当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小 D . 当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动 -
(5) PbCl2经“沉淀转化”后得到PbSO4 , 当c(Cl-)=0.1mol·L-1时,c(SO42-)=。
-
(6) “滤液a”经过处理后可以返回到工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为。

已知:①UO22+在pH为4-5的溶液中生成UO2(OH)2沉淀;②Fe2+和Fe3+沉淀完全的pH分别为9.7、3.7。
-
(1) 酸浸过程中MgBO2(OH)与硫酸反应的离子方程式为。
-
(2) 酸浸过程中加入H2O2的目的是(写出两条),滤渣1的主要成分是(填化学式)。
-
(3) 试剂1最好选择(填化学式)。若调节溶液pH前,溶液中c(Mg2+)=0.2 mol/L,当溶液pH调至5时,UO2+沉淀完全,此时是否有Mg(OH)2沉淀生成。{通过计算说明,Ksp[Mg(OH)2]=5.6×10-12}
-
(4) 操作1的名称是。
-
(5) MgSO4·H2O加热脱水可以得无水MgSO4 , 那么MgCl2·6H2O晶体直接加热(填“能”或“不能”)得到无水MgCl2 , 理由是。
-
(6) 已知:H2CO3的Ka1=4.4×10-7 , Ka2=4.7×10-11;H3BO3的Ka=5.8×10-10。向碳酸钠溶液里逐滴加入硼酸溶液(填“有”或“无”)气泡产生,理由是。
 主要成分为Fe2O3、FeO、SiO2等
主要成分为Fe2O3、FeO、SiO2等  为原料制取聚合硫酸铁(Fe2(OH)x(SO4)(3-
为原料制取聚合硫酸铁(Fe2(OH)x(SO4)(3- 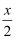 ))的工艺流程如图所示:
))的工艺流程如图所示: 
-
(1) “酸浸”时最合适的酸是
 写化学式
写化学式  。
。
-
(2) “酸浸”后溶液中主要的金属阳离子有。
-
(3) 加入KClO3的目的是(结合离子方程式说明)。
-
(4) “过程a”中生成聚合硫酸铁的过程是先水解再聚合,将下列水解反应原理的化学方 程式补充完整。Fe2(SO4)3+H2O
 Fe2(OH)x(SO4)(3-
Fe2(OH)x(SO4)(3- 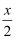 )+。
)+。
-
(5) 盐基度B是衡量絮凝剂絮凝效果的重要指标,通常盐基度越高,絮凝效果越好。已知盐基度B的表达式为B=
 ×100%(n为物质的量
×100%(n为物质的量  。为测出聚合硫酸铁的盐基度,进行如下实验操作:
。为测出聚合硫酸铁的盐基度,进行如下实验操作:  取聚合硫酸铁样品mg,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+ , 使Fe3+不与OH-反应,然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0mL。
取聚合硫酸铁样品mg,加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,再加入KF溶液屏蔽Fe3+ , 使Fe3+不与OH-反应,然后以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V0mL。 做空白对比实验:取与步骤i等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。
做空白对比实验:取与步骤i等体积等浓度的盐酸,以酚酞为指示剂,用c mol/L的标准NaOH溶液进行中和滴定,到终点时消耗NaOH溶液V mL。①该聚合硫酸铁样品中,n(OH-)= mol。
②已知该样品中Fe的质量分数为
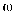 ,则盐基度B=。
,则盐基度B=。
 Fe
Fe  FeCl3
B . H2O2
FeCl3
B . H2O2  H2
H2  H2O
C . CaCl2溶液
H2O
C . CaCl2溶液  CaCO3
CaCO3  CO2
D . CuSO4溶液
CO2
D . CuSO4溶液 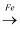 Cu
Cu  CuO
CuO
![]()
 +H2O
B . Cu2++2OH- =Cu(OH)2↓
C .
+H2O
B . Cu2++2OH- =Cu(OH)2↓
C .  +Ba2+=BaSO4↓
D .
+Ba2+=BaSO4↓
D .  +Ba2+=BaCO3↓
+Ba2+=BaCO3↓
| 甲 | 乙 | 丙 | |
| A | Cu | CuO | Cu(OH)2 |
| B | CaO | Ca(OH)2 | CaCO3 |
| C | Na | NaOH | Na2SO4 |
| D | O2 | H2O | H2 |

已知:常温下Fe3+、Mg2+完全沉淀的pH分别是3.4、12.4。
-
(1) 滤渣A的化学式为。
-
(2) 滤液1加H2O2氧化的过程中主要反应的离子方程式为。
-
(3) 加20%NaOH溶液调节pH=12.5,得到滤渣C的主要成分是。
-
(4) 常温下,用BaCl2·2H2O配制成0.2mol·L-1水溶液与等浓度的氟化铵溶液反应,可得到氟化钡沉淀。已知Ksp(BaF2)=1.84×10-7 , 当钡离子完全沉淀时(即钡离子浓度≤10-5mol·L-1),至少需要的氟离子浓度是 mol·L-1。(结果保留三位有效数字,已知
 =1.36)
=1.36)
-
(5) 已知:Ksp(BaCO3)=2.58×10-9 , Ksp(BaSO4)=1.07×10-10。将氯化钡溶液滴入等物质的量浓度的硫酸钠和碳酸钠的混合溶液中,当BaCO3开始沉淀时,溶液
 =。(结果保留三位有效数字)
=。(结果保留三位有效数字)

选项 | 素质教育 | 化学知识或原理 |
A | 音乐:“音乐焰火”创造出火树银花不夜天 | 焰色反应属于化学变化 |
B | 体育:北京冬奥会火炬外壳材料是由高性能树脂与碳纤维融合而成的复合材料 | 该复合材料具有耐高温、耐腐蚀等优良的特性 |
C | 美术:宋代《千里江山图》中的绿色来自孔雀石颜料[主要成分为Cu(OH)2·CuCO3],青色来自蓝铜矿颜料[主要成分为Cu(OH)2·2CuCO3] | 孔雀石、蓝铜矿颜料不易被空气氧化且耐酸、耐碱 |
D | 文学:爆竹声中一岁除,春风送暖入屠苏 | 传统爆炸粉为黑火药,其主要成分为木炭、硫磺、KClO3 |



