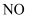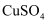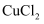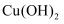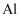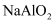常见金属元素的单质及其化合物的综合应用 知识点题库
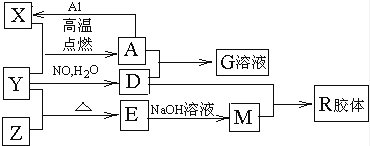
图中X、Y、Z为单质,其他为化合物,它们之间存在如下转化关系(部分产物已略去).其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应.
回答下列问题:
(1)组成单质Y的元素在周期表中的位置是 ;M中存在的化学键类型为 R的化学式是 .
(2)一定条件下,Z与H2反应转化为ZH4 . ZH4的电子式为
.
(3)已知A与1mol Al反应转化为X时(所有物质均为固体),放出akJ热量,写出该反应的热化学方程式: .
(4)写出A和D的稀溶液反应生成G的离子方程式: .
(5)向含4mol D的稀溶液中,逐渐加入X粉末至过量,假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值 .
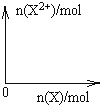
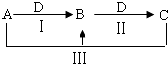
-
(1) 若A为氯碱工业的产品,C为厨房中的用品.
①D的电子式是.
②反应Ⅲ的离子方程式是.
③氯碱工业制备A的化学方程式是,其中两种产物可与KI溶液反应制得一种化工原料,若消耗0.1mol KI转移电子0.6mol,则三种物质间反应的离子方程式是.
-
(2) 若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料.
①反应Ⅲ的离子方程式是.
②B可作净水剂,在使用时发现B不能使酸性废水中的悬浮物沉降除去,其原因是.

-
(1) 浅绿色溶液D主要成分的化学式为,试剂1是.
-
(2) 下列物质不能作为试剂2的是(填序号).
a.Cl2 b.新制氯水 c.浓硫酸 d.S e.硝酸
-
(3) 固体A溶于稀盐酸的化学方程式.
-
(4) 溶液C到溶液F红色加深的原因是.
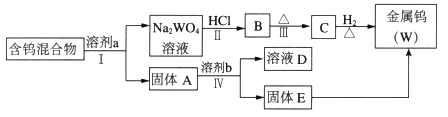
请阅读资料卡片并回答下列问题。
【资料卡片】
i.WO3易溶于NaOH、Na2CO3和Na2C2O4(草酸钠)溶液并形成钨酸盐(Na2WO4);W2O5易被氧化,也能溶解在上述溶液中;金属钨和WO2不溶于上述溶液。
ii.WO3几乎不与无机酸反应。
iii.钨化合物在不同溶剂中的浸取率见下表(浸取是用溶剂溶解固体混合物,以分离可溶组分及残渣的过程。若浸取率为100%,则固体中的可溶组分全部溶解在溶剂中)。
溶剂 | 煮沸时间(min) | W2O5(%) | WO3(%) | WO2 | 金属钨 |
①100g/L NaOH | 25 | 72.3 | 100 | 未检出 | 未检出 |
②300g/LNa2CO3 | 7 | 76.4 | 100 | ||
③50g/LNa2CO3 | 30 | 100 | 100 | ||
④饱和Na2C2O4 | 60 | 4.2 | 100 | ||
⑤饱和Na2C2O4 (在CO2气氛下浸取) | 120 | <0.5 | 100 |
-
(1) 步骤Ⅰ和Ⅳ均要进行的操作是。
-
(2) 步骤Ⅱ、Ⅲ反应的化学方程式分别是、。
-
(3) WO3既属于金属氧化物,也属于氧化物,与NaOH溶液反应的离子方程式是。
-
(4) 步骤Ⅰ是将WO3分离出来,选用的溶剂a是⑤,理由是。
-
(5) 步骤Ⅳ可将W2O5分离出来,选用的溶剂b是(填序号),固体E中含有的物质是,D中溶质是。
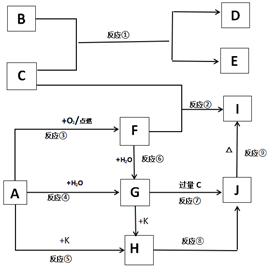
填写下列空白:
-
(1) 写出化学式:B,F。
-
(2) 写出反应①的化学反应方程式:。
-
(3) 写出反应⑦离子反应方程式:。
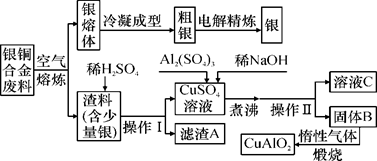
[已知Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃]。下列关于该流程的说法错误的是( )
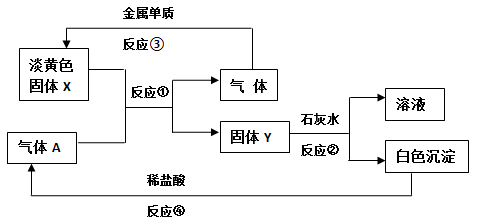
请回答下列问题
-
(1) 固体X的名称 ,A的化学式 。
-
(2) 反应①的化学方程式。
-
(3) 写出反应②④的离子方程式:。。
 B .
B .  C .
C .  D .
D . 
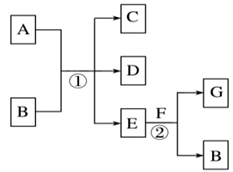
-
(1) A的名称为,F的重要用途有。
-
(2) 写出反应①的化学方程式:。
-
(3) 写出反应②的化学方程式:。
-
(4) 已知A是一种重要的化工原料,在工农业生产和生活中有着重要的应用。请根据所学知识回答下列问题。
①将A通入紫色石蕊溶液中,观察到的现象是。
②A与石灰乳反应制得的漂白粉的有效成分是(填化学式),该物质在空气中失效的原因是(写出第一步反应即可)(用化学方程式表示)。
| 选项 | W | X | Y | Z | |
| A | | | | | |
| B | | | | | |
| C | | | | | |
| D | | | | |
选项 | A | B | C | D |
物质名称 | 食盐 | 漂粉精 | 生石灰 | 呼吸面具 |
有效成分 | NaCl | Ca(ClO)2 | Ca(OH)2 | Na2O2 |
主要用途 | 做调味品 | 做漂白剂、消毒剂 | 做干燥剂 | 做供氧剂 |
 B . 稀盐酸
B . 稀盐酸 漂白粉
C . 饱和NaCl溶液
漂白粉
C . 饱和NaCl溶液 D .
D .