常见金属元素的单质及其化合物的综合应用 知识点题库
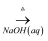 NaAlO2(aq)
NaAlO2(aq)  Al(OH)3
B . S
Al(OH)3
B . S  SO3
SO3  H2SO4
C . Mg(OH)2
H2SO4
C . Mg(OH)2  MgCl2(aq)
MgCl2(aq)  无水MgCl2
D . Fe
无水MgCl2
D . Fe  Fe2O3
Fe2O3  FeCl3
FeCl3
-
(1) 在元素周期表中,铜、银、金元素位于同一族,它们基态原子的价层电子排布式中各能级上的电子数相等,各能层数依次增大,其通式为(用n表示核外电子层数);铜元素所在周期中,基态原子未成对电子数最多的原子M 的价层电子轨道表达式为.
-
(2) 乙醛是重要的化工原料,①CH3CH2OH、CH3CHO的沸点分别为78.5℃、20.8℃,它们的相对分子质量相差2,而沸点相差比较大,其主要原因.
②在H、C、N、O中,第一电离能最大的元素和电负性最大的元素组成的化合物的化学式为(填一种即可),CH4、NH3、H2O分子的键角从大到小的顺序为.
-
(3) 金不溶于硝酸,但溶于“王水”,发生如下反应:Au+4HCl+HNO3═H+NO+2H2O,金溶于王水的主要原因是形成了﹣ , 提高了金的活泼性.在﹣中配位键的数目为,写出该离子的结构式:.
-
(4) 金、银的一种合金具有较强的储氢能力.该合金的晶胞为面心立方结构,银原子位于面心,金原子位于顶点.该合金的化学式可以表示为.
-
(5) Cu(OH)2难溶于氢氧化钠溶液,但是易溶于浓氨水,用离子方程式表示其主要原因:.
①取适量粉末投入蒸馏水中,粉末完全溶解,得到蓝色透明溶液A.
②取A溶液少量,向其中逐滴滴加烧碱溶液直到过量,观察到先有沉淀出现,而后沉淀逐渐增多,然后沉淀又逐渐减少,但最终仍有部分蓝色沉淀.
③再取A溶液两份,一份滴加BaCl2溶液后,出现白色沉淀;另一份滴加硝酸银溶液后也出现白色沉淀.
请回答下列问题:
-
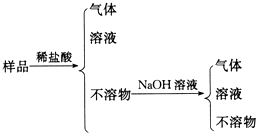
(1) 原白色粉末一定含有,一定不含,可能含有.(填化学式)
-
(2) 写出过程②中涉及到的离子方程式:.
-
(3) 如果要进一步确定可能存在的物质,进行的实验操作及实验现象和结论是.
①CaCl2溶液;②Na2SiO3溶液;③Ca(OH)2溶液;④饱和Na2CO3溶液
① 
② 
③ 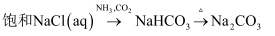
④ 

完成下列填空:
-
(1) 铝原子核外有种不同能量的电子,最外层电子的轨道式是,上述流程涉及第二周期元素的原子半径由小到大的顺序是。
-
(2) “除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为,检验溶液中Fe3+是否除尽的方法是。
-
(3) 解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。
-
(4) 上述流程可循环的物质是。
-
(5) 工业上将Al2O3溶解在熔化的冰晶石中电解获得铝,该反应的化学方程式为。
 并探究其性质。
并探究其性质。 资料:  为紫色固体,微溶于
为紫色固体,微溶于  溶液;具有强氧化性,在酸性或中性溶液中快速产生
溶液;具有强氧化性,在酸性或中性溶液中快速产生  ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
-
(1) 制备
 (夹持装置略)
(夹持装置略) 
①A为氯气发生装置。A中反应的离子方程式为(锰被还原为
 )。
)。②请在B方框内将除杂装置补充完整,并标明所用试剂。
③
 中得到紫色固体和溶液。
中得到紫色固体和溶液。  中主要反应的化学方程式为。
中主要反应的化学方程式为。 -
(2) 探究
 的性质
的性质 ①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否  氧化了
氧化了  而产生
而产生  ,设计以下方案:
,设计以下方案:方案Ⅰ
取少量a,滴加
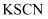 溶液至过量,溶液呈红色。
溶液至过量,溶液呈红色。方案Ⅱ
用KOH溶液充分洗涤C中所得固体,再用KOH溶液将
 溶出,得到紫色溶液b。取少量b,滴加盐酸,有
溶出,得到紫色溶液b。取少量b,滴加盐酸,有  产生。
产生。由方案Ⅰ中溶液变红可知a中含有的离子为,但该离子的产生不能判断一定是
 将
将  氧化,该离子还可能由产生(用离子方程式表示)。
氧化,该离子还可能由产生(用离子方程式表示)。②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性 
 (填“>”或“<”),而方案Ⅱ实验表明,
(填“>”或“<”),而方案Ⅱ实验表明,  和
和  的氧化性强弱关系相反,原因是。
的氧化性强弱关系相反,原因是。③资料表明,酸性溶液中的氧化性
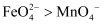 ,验证实验如下:将溶液
,验证实验如下:将溶液 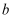 滴入
滴入 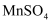 和足量
和足量  的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性
的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性  。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:。
。若能,请说明理由;若不能,进一步设计实验方案。理由或方案:。

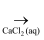 CaSO3
CaSO3  CaSO4
B . Fe3O4(s)
CaSO4
B . Fe3O4(s)  Fe(s)
Fe(s) 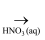 Fe(NO3)3(aq)
C . MgO(s)
Fe(NO3)3(aq)
C . MgO(s)  MgSO4(aq)
MgSO4(aq)  Mg(s)
D . Fe
Mg(s)
D . Fe 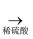 FeSO4(aq)
FeSO4(aq)  Fe(OH)2
Fe(OH)2  FeO
FeO
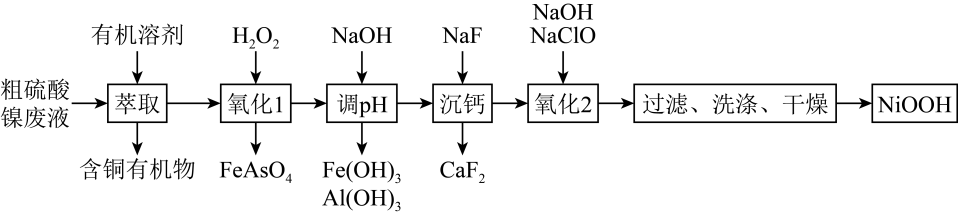
已知:Ksp(FeAsO4)=5.7×10-21 , H3AsO3的还原性比Fe2+强。
回答下列问题:
-
(1) “萃取”时需充分振荡,目的是。
-
(2) “氧化1”中H2O2的作用是,若该废液中H3AsO3和Fe2+的浓度分别是0.02 mol·L-1和0.12 mol·L-1 , 除去砷后的废液中c(
 )=mol·L-1(不考虑反应过程中溶液体积的微小变化)
)=mol·L-1(不考虑反应过程中溶液体积的微小变化)
-
(3) “沉钙”时,若溶液酸度过高,Ca2+沉淀不完全,原因是。
-
(4) “氧化2”反应的离子方程式为。
-
(5) “洗涤”时,检验产品是否洗涤干净的方法是。
-
(6) 已知某镍氢电池的离子导体为KOH溶液,电池反应为MH+NiOOH
 M+Ni(OH)2 , 则放电时,OH-移向电极(填“MH”或“NiOOH”),充电时NiOOH电极上的电极反应式为。
M+Ni(OH)2 , 则放电时,OH-移向电极(填“MH”或“NiOOH”),充电时NiOOH电极上的电极反应式为。

-
(1) 请用离子方程式表示B装置中饱和
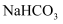 溶液的作用:,请写出装置C中发生的两个化学反应方程式、。
溶液的作用:,请写出装置C中发生的两个化学反应方程式、。
-
(2) 装置C中发生反应的还原剂为(写化学式),每生成1分子
 , 转移个电子。
, 转移个电子。
-
(3) E装置为氧气收集装置,下面4套气体收集装置中,合理的是(填序号)。
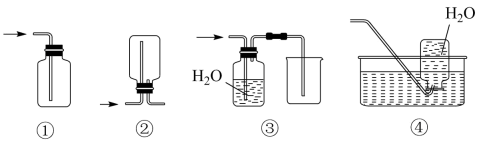
-
(4)
 溶液与
溶液与 溶液外观高度相似,请设计实验鉴别这两种溶液,写出实验操作和现象。
溶液外观高度相似,请设计实验鉴别这两种溶液,写出实验操作和现象。



