常见金属元素的单质及其化合物的综合应用 知识点题库
①少量Ca(OH)2投入过量NaHCO3溶液中
②过量NaOH溶液和明矾溶液混合
③金属钠投入到FeCl2中
④向NaAlO2溶液中通入过量CO2
⑤向饱和Na2CO3溶液中通入过量CO2 .
-
(1) 在稀硫酸酸化的双氧水中加入二氧化锰粉末,产生大量气泡,且黑色固体消失;向反应完全后的溶液中加入高锰酸钾溶液生成黑色沉淀.经检测:1mol KMnO4完全反应转移3mol电子.在双氧水参与的反应中,二氧化锰除了作催化剂还作;写出加入高锰酸钾后产生黑色沉淀的离子方程式.
-
(2) 菱锰矿是生产铁锰合金中锰的来源,其主要成分是碳酸锰.已知锰常见的化合价有+2、+4、+6、+7.在空气中灼烧菱锰矿生产四氧化三锰,然后用铝热反应制备锰.写出菱锰矿粉末在空气中高温灼烧生成四氧化三锰的化学方程式.如果冶炼1100kg锰,理论上消耗铝的质量为 kg.
-
(3) 工业生产中为了制备硫酸锰,往往将硫酸锰溶液中亚铁离子氧化成铁离子,调节pH除去铁离子.向混合溶液中滴加稀硫酸酸化,加入软锰矿(主要成分是二氧化锰)氧化亚铁离子,写出该过程的离子方程式.
-
(4) 酸性高锰酸钾可氧化乙醇,配平下列反应方程式:
KMnO4+H2SO4+CH3CH2OH=K2SO4+MnSO4+CH3COOH+.
| 选项 | 化学性质 | 实际应用 |
| A | NH3具有还原性 | 用作食品工业的制冷剂 |
| B | K2FeO4易与H2O反应生成Fe(OH)3 | 用作水的消毒剂和絮凝剂 |
| C | Ag2O具有氧化性 | 用作银锌纽扣电池正极的活性物质 |
| D | 硫酸铝能与小苏打溶液反应 | 用作泡沫灭火剂原料 |
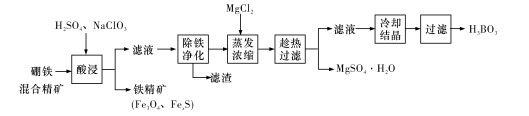
已知: 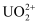 在pH为4~5的溶液中生成UO2(OH)2沉淀。
在pH为4~5的溶液中生成UO2(OH)2沉淀。
回答下列问题:
-
(1) “酸浸”时,为了提高浸出率可采取的措施有: (至少答两个措施),该步骤中NaClO3可将UO2转化为
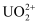 ,则该反应的离子方程式为。
,则该反应的离子方程式为。
-
(2) “除铁净化”需要加入(填化学式)把溶液pH调节至4~5,滤渣的成分是。
-
(3) “蒸发浓缩”时,加入固体MgCl2的作用是 。
-
(4) 铁精矿(Fe3O4、FexS)经过一系列加工后,可用于制备氢氧化铁固体。已知T℃,
 ,
,  ,
,  回答下列问题:
回答下列问题:①在T℃,假设Fe3+水解的离子方程式是:
 ,则该条件下Fe3+水解反应的平衡常数K=(用含以的字母表示)。
,则该条件下Fe3+水解反应的平衡常数K=(用含以的字母表示)。②在T℃向饱和Fe(OH)3、Fe(OH)2的混合溶液中,加入少量NaOH固体(忽略溶液体积变化),则溶液中的c(Fe2+)/c(Fe3+)会(填“变大”“变小”或“不变”),请结合相关数据推理说明:。
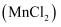 在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为Fe、Ni、Pb等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。 I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,过滤;
II.向I的滤液中加入一定量盐酸,再加入  溶液,充分反应后加入
溶液,充分反应后加入 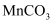 固体调节溶液的pH约为5,过滤;
固体调节溶液的pH约为5,过滤;
III.向II的滤液中通入  气体,待充分反应后加热一段时间,冷却后过滤;
气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水MnCl2。
各步骤中对杂质离子的去除情况
| | | | |
| 初始浓度/mg·L–1 | 21.02 | 4.95 | 5.86 |
| 步骤I后/ mg·L–1 | 12.85 | 3.80 | 3.39 |
| 步骤II后/ mg·L–1 | 0.25 | 3.76 | 3.38 |
| 步骤III后/ mg·L–1 | 0.10(达标) | 3.19(未达标) | 0.12(达标) |
已知:金属活动性Mn>Fe>Ni>Pb
-
(1) 锰和盐酸反应的化学方程式是。
-
(2) 步骤I中:
①Fe2+浓度降低,滤渣中存在
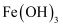 。结合离子方程式解释原因:。
。结合离子方程式解释原因:。②Pb2+浓度降低,分析步骤I中发生的反应为:Pb + 2H+ = Pb2+ + H2↑、。
-
(3) 步骤II中:
①
 酸性溶液的作用:。
酸性溶液的作用:。②结合离子方程式说明MnCO3的作用: 。
-
(4) 步骤III通入H2S后, Ni2+不达标而
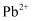 达标。推测溶解度:PbSNiS(填“>”或“<”)。
达标。推测溶解度:PbSNiS(填“>”或“<”)。
-
(5) 测定无水
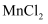 的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量
的含量:将a g 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量  ,使
,使  氧化为
氧化为  。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵
。待充分反应后持续加热一段时间,冷却后用b mol/L硫酸亚铁铵  滴定
滴定  ,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+)
,消耗c mL 硫酸亚铁铵。(已知:滴定过程中发生的反应为:Fe2+ + Mn3+ = Fe3+ + Mn2+) ①样品中MnCl2的质量分数是(已知:MnCl2的摩尔质量是126 g·mol-1)。
②“持续加热”的目的是使过量的
 分解。若不加热,测定结果会(填“偏高”、“偏低”或“无影响”)。
分解。若不加热,测定结果会(填“偏高”、“偏低”或“无影响”)。
 SiO2
SiO2  SiCl4
B . Cu
SiCl4
B . Cu  Cu(NO3)2(aq)
Cu(NO3)2(aq)  Cu(NO3)2(s)
C . ClCH2-CH2Cl
Cu(NO3)2(s)
C . ClCH2-CH2Cl  HOCH2-CH2OH
HOCH2-CH2OH  HOOC-COOH
D . Al
HOOC-COOH
D . Al  Al2O3
Al2O3  NaAlO2(aq)
NaAlO2(aq)
 Na2O
Na2O  Na2CO3
B . Fe
Na2CO3
B . Fe  Fe2O3
Fe2O3  Fe(OH)3
C . NaCl(aq)
Fe(OH)3
C . NaCl(aq)  NaHCO3(s)
NaHCO3(s)  Na2CO3(s)
D . Al2O3
Na2CO3(s)
D . Al2O3  Al3+
Al3+ 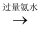 AlO
AlO 
①SO2  Na2SO3
Na2SO3  Na2SO4
Na2SO4
②Fe  Fe2O3
Fe2O3  Fe2(SO4)3
Fe2(SO4)3
③Al  Al2O3
Al2O3  NaAlO2
NaAlO2
④N2  NO
NO  NO2
NO2  HNO3
HNO3

请回答以下问题:
-
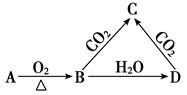
(1) 写出下列物质的化学式: H,J。
-
(2) 写出A跟盐酸反应生成B的化学方程式:。
-
(3) 写出C跟氯气反应生成E的化学方程式:.。
 B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 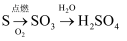
| 选项 | X | Y | Z | W | |
| A | Al | Cu | CuO | CuCl2 | |
| B | HCl | NaCl | Na2CO3 | NaOH | |
| C | H2O2 | O2 | H2O | H2CO3 | |
| D | Fe2O3 | FeCl3 | Fe(OH)3 | Fe |
 、
、 、
、 均可由相应的单质直接化合生成
C . 等质量的铜分别与足量的浓硝酸和稀硝酸充分反应,转移的电子数相等
D . 将
均可由相应的单质直接化合生成
C . 等质量的铜分别与足量的浓硝酸和稀硝酸充分反应,转移的电子数相等
D . 将 通入酸性
通入酸性 溶液中,溶液褪色,说明
溶液中,溶液褪色,说明 具有漂白性
具有漂白性
 , 还含有少量的
, 还含有少量的 和
和 )是制取铜及其化合物的主要原料之一,还可用于制备绿矾(化学式为
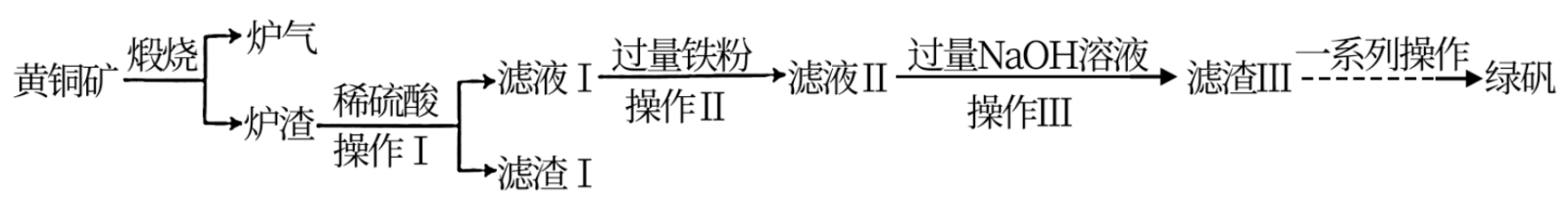
)是制取铜及其化合物的主要原料之一,还可用于制备绿矾(化学式为 )。
)。
-
(1) 黄铜矿“煅烧”时发生的反应为
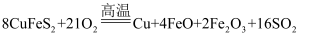 。若
。若 中Fe的化合价为+2价,则该反应中被还原的元素是(填元素符号)。
中Fe的化合价为+2价,则该反应中被还原的元素是(填元素符号)。
-
(2) “滤渣Ⅰ”的主要成分为,“滤渣Ⅲ”的主要成分为。(填化学式)
-
(3) “滤液Ⅱ”中含有的金属阳离子有(填离子符号)。
-
(4) 上述"煅烧"过程会产生“炉气"(主要成分为
 )。下列对“炉气”的处理方案中合理的是____(填标号)。
A . 高空排放 B . 用于制备硫酸 C . 用纯碱溶液吸收制
)。下列对“炉气”的处理方案中合理的是____(填标号)。
A . 高空排放 B . 用于制备硫酸 C . 用纯碱溶液吸收制 D . 用浓硫酸吸收
D . 用浓硫酸吸收
-
(5) “操作I”的名称为。
-
(6) 由“滤渣Ⅲ”制备绿矾的过程中需要用到的试剂有(填名称),“一系列操作”为。

已知:65℃时Ksp[Mg(OH)2]= 1.8×10-11 Ksp[Zn(OH)2]=2.0×10-17 Kw=10-13 lg2≈0.3
回答下列有关问题:
-
(1) 浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是,还可采用(写出一种)等方式达到此目的。
-
(2) “氧化除铁”在90℃,控制溶液pH在4.0-5.0,得到针铁矿渣的离子方程式为。
-
(3) “沉锌”前,滤液(65℃)中含有0.50 mol·L-1 Zn2+和1.8 mol·L-1 Mg2+ , 保持该温度,则应加入氨水调节pH在范围(c≤1.0×10-5mol·L-1 , 沉淀完全)。利用平衡移动原埋说明“沉锌”时加入氨水的作用是。
-
(4) “酸解”后获得ZnSO4·7H2O的操作依次经过蒸发浓缩、、过滤、洗涤、干燥。制得的ZnSO4·7H2O在烘干时需减压烘干的原因是。
-
(5) “滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀。写出“灼烧”步骤的化学方程式。
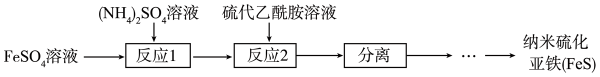
下列有关说法错误的是( )