化学实验方案的评价 知识点题库
实验目的 | 实验操作 | |
A. | 制备Fe(OH)3胶体 | 将NaOH浓溶液滴加到饱和FeCl3溶液中 |
B. | 由MgCl2溶液制备无水MgCl2 | 将MgCl2溶液加热蒸干 |
C. | 除去Cu粉中混有的CuO | 加入稀硝酸溶液,过滤、洗涤、干燥 |
D. | 比较水与乙醇中氢的活泼性 | 分别将少量钠投入到盛有水和乙醇的烧杯中 |
选项 | 实验操作 | 发生的现象 | 解释或结论 |
A | 向亚硫酸钠溶液中,逐滴加入硝酸酸化的硝酸钡溶液 | 产生白色沉淀 | 产生的亚硫酸钡是难溶解入水的沉淀 |
B | 将SO2通入滴有酸性高锰酸钾溶液中 | 溶液紫红色褪去 | SO2具有漂白性 |
C | 常温下铜片插入硝酸中 | 产生红棕色气体 | 常温下铜硝酸一定产生NO2 |
D | 向某溶液中加入NaHCO3 | 产生白色沉淀 | 该溶液可能原来含有氢氧化钡 |
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某溶液中滴入少量盐酸,然后滴入少量的氯化钡溶液 | 先无明显现象,后有白色沉淀. | 说明原溶液中含有SO42﹣ |
B | 向某氯化亚铁溶液中滴入少量氯水,然后滴入少量的KSCN溶液 | 溶液变成血红色 | 说明原氯化亚铁已氧化变质 |
C | 加热分解某盐X,将产生的气体通入硝酸酸化的BaCl2溶液 | 实验开始立即产生白色沉淀 | X可能是NaHCO3 |
D | 向溶液X中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |

熔点/℃ | 沸点/℃ | 密度/g•cm﹣3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | ﹣97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | ﹣12.3 | 199.6 | 1.09 | 不溶 |
有关数据如表所示,请回答下列问题:
-
(1) 在烧瓶中混合有机物及浓硫酸的方法是,装置C如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是.
-
(2) B装置的冷凝管的主要作用是,可否换为球形冷凝管(填“可”或“否”).
-
(3) 制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号).
-
(4) A中Na2CO3的作用是;D装置的作用是
-
(5) 在洗涤、分液操作中,应充分振荡,然后静置,待分层后(填标号).
a.直接将苯甲酸甲酯从分液漏斗的上口倒出
b.直接将苯甲酸甲酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从下口放出
d.先将水层从分液漏斗的下口放出,再将苯甲酸甲酯从上口倒出.
 B .
B .  C .
C .  D .
D . 
|
| |||||
| A | B | C | D | E | F |
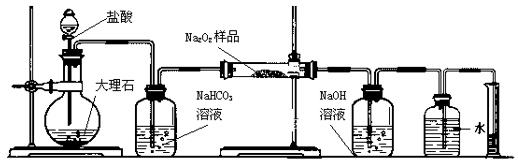
-
(1) 写出装置A中两种主要玻璃仪器的名称、。
-
(2) 写出装置A中发生的离子方程式。
-
(3) 装置B的作用是。
-
(4) 写出装置C中发生反应的主要化学方程式:。
-
(5) 装置D中 NaOH的作用是。
-
(6) 他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为224mL,则样品中过氧化钠的质量分数为
| 编号 | 实验目的 | 实验方案 |
| A | 比较C和Si的非金属性强弱 | 向Na2SiO3溶液中通入CO2 , 观察溶液中的现象 |
| B | 探究SO2的漂白性 | 向装有品红溶液的试管中通入SO2 , 观察溶液中的现象,加热,再次观察现象 |
| C | 制备Fe(OH)3胶体 | 在盛有氯化铁溶液的烧杯中倒入氢氧化钠溶液 |
| D | 检验氯气的产生 | 将湿润的淀粉KI试纸靠近导管口,观察试纸变色现象 |
| 选项 | 实验操作和现象 | 实验结论 |
| A | 向1mL1%的NaOH溶液中加入2mL 的CuSO4溶液, 振荡后再加入0.5mL有机物Y,加热,未出现砖红色沉淀 | Y中不含有醛基 |
| B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,瓶中产生大量白烟和黑色颗粒 | CO2具有氧化性 |
| C | 加热盛有少量NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸,石蕊试纸变蓝 | NH4HCO3显碱性 |
| D | 向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液,溶液红色逐渐褪去 | BaCl2溶液呈酸性 |

| 选项 | 实验目的 | 实验方法 | 实验原理 |
| A | 除去 | 蒸发浓缩冷却结晶 | NaCl的溶解度随温度变化改变较大 |
| B | 除去 | 将混合气体通过盛有水的洗气瓶 | |
| C | 检验 | 向混合溶液中滴加酸性高锰酸钾 | |
| D | 检验氯气已收集满 | 将湿润的淀粉-碘化钾试纸置于集气瓶口 | 氯气可将碘化钾氧化生成碘使试纸变蓝 |
选项 | 实验操作和现象 | 结论 |
A | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
B | 向碘水中加入等体积CCl4 , 充分振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向淀粉溶液中加适量20%H2SO4溶液,加热,冷却后加NaOH溶液至中性,再滴加少量碘水,溶液变蓝 | 淀粉未水解 |
D | 向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色 | X溶液中一定含有Fe2+ |
选项 | 实验 | 结论 |
A | 将0.1 mol∙L−1氨水稀释成0.01 mol∙L−1 , 测得pH由11.1变成10.6 | 稀释后,NH3·H2O的电离程度减小 |
B | 室温下,用pH计分别测定同浓度的NaClO和CH3COONa溶液的pH,NaClO溶液pH大 | 酸性:HClO<CH3COOH |
C | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,有白色沉淀生成,溶液红色变浅 | 证明纯碱溶液呈碱性是由CO |
D | 在AgCl悬浊液中滴入数滴0.1 mol∙L−1 KI溶液,生成黄色沉淀 | 同温下溶解度:AgCl>AgI |
实验目的 | 实验药品 | |
A | 证明乙炔能和Br2反应 | 电石、饱和食盐水、CuSO4溶液和溴水 |
B | 除去粗盐中的Ca2+、Mg2+和SO | 粗盐、蒸馏水、NaOH溶液和Na2CO3溶液 |
C | 检验溴乙烷中的溴原子 | 溴乙烷、NaOH溶液和AgNO3溶液 |
D | 验证乙醇消去产物有乙烯 | 乙醇、浓硫酸和溴水 |
| 选项 | 实验目的 | 实验方案 |
| A | 制备无水FeCl3固体 | 将FeCl3溶液加热蒸干 |
| B | 检验浓H2SO4催化纤维素水解的产物含有还原糖 | 向水解后的溶液中加入新制的Cu(OH)2 , 加热 |
| C | 配制1L1.0mol/LNaCl溶液 | 将58.5gNaCl固体直接溶于1L水中 |
| D | 证明醋酸是弱电解质 | 测0.1mol/LCH3COOH溶液的pH |

-
(1) 灼烧时,海带需用润湿后放在(填仪器名称)中进行灼烧。
-
(2) 可以代替上述流程④中氯气的最佳试剂是,同时加入稀硫酸酸化,反应的离子方程式为。
-
(3) 下列有关流程⑤的叙述错误的是(填字母)。
a.用到的主要玻璃仪器是分液漏斗和烧杯
b.也可选择苯或酒精作萃取剂
c.操作时,充分振荡后,分液漏斗下口向上倾斜,打开活塞,使漏斗内气体放出;静置后打开上口的旋塞,先将水层倒出,然后放出下层溶液。
-
(4) 流程⑥发生的化学方程式为,加入45%的硫酸时生成1mol碘单质转移的电子数目为,上述流程中可以循环利用的物质是。
实验目的 | 玻璃仪器 | 试剂 | |
A | 配制100g溶质质量分数为16%的NaCl溶液 | 100mL容量瓶、胶头滴管、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
B | 利用乙醇制备乙烯 | 圆底烧瓶、酒精灯、玻璃导管、集气瓶 | 乙醇、浓硫酸 |
C | 制备乙酸乙酯 | 试管、玻璃导管、酒精灯 | 无水乙醇、浓硫酸、冰醋酸、饱和碳酸钠溶液 |
D | 鉴别乙醛和苯酚 | 试管、胶头滴管、烧杯、玻璃棒、酒精灯 | 2mL10% |
 中的NaCl
中的NaCl 中的NO
中的NO 和
和  中的
中的 
 水解引起的
水解引起的
 溶液、5~6滴2%NaOH溶液
溶液、5~6滴2%NaOH溶液


