共价键的形成及共价键的主要类型 知识点题库
下列物质的分子中既有σ键又有π键的是( )
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2
A . ①②③
B . ③④⑤⑥
C . ①③⑥
D . ③⑤⑥
分析下列化学式中划有横线的元素,请选出符合要求的物质,填写在横线上.
A.NH3 B.H2O C.HCl D.CH4 E.C2H6 F.N2
(1)所有的价电子都参与形成共价键的是 .
(2)只有一个价电子参与形成共价键的是 .
(3)最外层有未参与成键的电子对的是 .
(4)既有σ键,又有π键的是
下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A . H2+CuO═Cu+H2O
B . 2Na2O2+2H2O═4NaOH+O2↑
C . H2+Cl2═2HCl
D . 2NaOH+Cl2═NaCl+NaClO+H2O
下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( )
A . sp杂化轨道的夹角最大
B . sp2杂化轨道的夹角最大
C . sp3杂化轨道的夹角最大
D . sp3、sp2、sp杂化轨道的夹角相等
下列物质中,既含有离子键又含有共价键的是( )
A . KOH
B . LiCl
C . H2
D . NH3
水分子中不存在( )
A . 共价键
B . 离子键
C . 极性键
D . 共用电子对
下列说法错误的是( )
A . 在共价化合物中一定含有共价键
B . 由非金属元素组成的化合物一定是共价化合物
C . 含有离子键的化合物一定是离子化合物
D . 双原子单质分子中的共价键一定是非极性键
下列物质中,既有离子键,又有共价键的是( )
A . KCl
B . NH4Cl
C . H2O
D . CH4
下列有关晶体的说法中正确的是( )
A . 氯化钾溶于水时离子键未被破坏
B . 金属晶体中金属键越强,熔点越高
C . 冰融化时分子中共价键发生断裂
D . 分子间作用力越大,分子越稳定
有关乙炔分子中的化学键描述不正确的是( )
A . 两个碳原子采用sp杂化
B . 两个碳原子采用sp2杂化
C . 每个碳原子都有两个未杂化的2p轨道形成π键
D . 两个碳原子形成两个π键
碳是地球上组成生命的最基本的元素之一。根据要求回答下列问题:
-
(1) 碳原子的价电子排布图:,核外有种不同运动状态的电子。
-
(2) 碳可以形成多种有机化合物,下图所示是一种嘌呤和一种吡啶的结构,两种分子中所有原子都在一个平面上。

①嘌呤中所有元素的电负性由大到小的顺序。
②嘌呤中轨道之间的夹角∠1比∠2大,解释原因。
③吡啶结构中N 原子的杂化方式。
④分子中的大π键可以用符号
 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为  )。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为。
)。该嘌呤和吡啶中都含有大π键,请问该吡啶中的大π键表示为。 -
(3) 碳可形成CO、CO2、H2CO3等多种无机化合物。
①在反应CO 转化成CO2 的过程中,下列说法正确的是。
A.每个分子中孤对电子数不变
B.分子极性变化
C.原子间成键方式改变
D.分子的熔沸点变大
②干冰和冰是两种常见的分子晶体,晶体中的空间利用率: 干冰冰。(填“>”、 “<”或“=”)
③H2CO3与H3PO4 均有1个非羟基氧,H3PO4为中强酸,H2CO3为弱酸的原因。
-
(4) 在2017 年,中外科学家团队共同合成了碳的一种新型同素异形体: T- 碳。T- 碳的结构是: 将立方金刚石中的每个碳原子用一个由4 个碳原子组成的正四面体结构单元取代,形成碳的一种新型三维立方晶体结构,如下图。已知T- 碳晶胞参数为a pm,阿伏加德罗常数为NA , 则T- 碳的密度的表达式为g/cm3。

下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的是( )
A . NH4Cl  NH3↑+HCl↑
B . NH3+CO2+H2O=NH4HCO3
C . 2Na2O2+2H2O=4NaOH+O2↑
D . 2NaOH+Cl2=NaCl+NaClO+H2O
NH3↑+HCl↑
B . NH3+CO2+H2O=NH4HCO3
C . 2Na2O2+2H2O=4NaOH+O2↑
D . 2NaOH+Cl2=NaCl+NaClO+H2O
下列关于共价键的说法不正确的是( )
A . 在双键中,σ键比π键稳定
B . N2与CO分子中σ键和π键个数对应相等
C . 两个原子形成共价键时至少有1个σ键
D . HCHO分子中σ键与π键个数比为2∶1
B3N3H6(无机苯)的结构与苯类似,也有大π键。下列关于B3N3H6的说法错误的是( )
A . 其熔点主要取决于所含化学键的键能
B . 形成大π键的电子全部由N提供
C . 分子中B和N的杂化方式相同
D . 分子中所有原子共平面
下列说法正确的是( )
①离子化合物一定含离子键,也可能含共价键;
②共价化合物一定含共价键,也可能含离子键;
③含金属元素的化合物不一定是离子化合物;
④由非金属元素组成的化合物一定是共价化合物;
⑤由分子组成的物质中一定存在共价键;
⑥熔融状态能导电的化合物一定是离子化合物
A . ①③⑤
B . ②④⑥
C . ②③④
D . ①③⑥
已知短周期主族元素X、Y、Z、W和Q的原子序数依次增大,X与Q同主族,其中四种元素可形成化合物M,M的结构简式如图,下列说法错误的是( )

A . X、Z和W可以形成离子化合物
B . 简单离子半径:W<Q
C . W和Q形成的化合物可能含非极性共价键
D . 简单氢化物的沸点:W>Z>Y
甲醛( )与
)与 在羟基磷灰石(
在羟基磷灰石( )表面发生反应的能量—历程关系如图。下列说法错误的是( )
)表面发生反应的能量—历程关系如图。下列说法错误的是( )
 )与
)与 在羟基磷灰石(
在羟基磷灰石( )表面发生反应的能量—历程关系如图。下列说法错误的是( )
)表面发生反应的能量—历程关系如图。下列说法错误的是( )
A . 该反应为放热反应
B . 反应过程中,甲醛的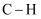 键断裂
C .
键断裂
C .  中的氧原子全部来自
中的氧原子全部来自 D . 化学方程式为
D . 化学方程式为
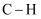 键断裂
C .
键断裂
C .  中的氧原子全部来自
中的氧原子全部来自 D . 化学方程式为
D . 化学方程式为
下列关于共价键的描述错误的是( )
A . 键长: O-H<N-H<C-H
B . C2H4中碳碳键的键能: σ键>π键
C . 分子中的键角: NH3<CH4
D . 气体单质中一定存在σ键
下列说法正确的是( )
A . 离子键就是阴、阳离子间的静电引力
B . 所有金属元素与所有非金属元素之间都能形成离子键
C . HCl在水中能电离出H+和Cl- , 所以HCl由H+和Cl-构成
D . 某化合物熔融态能导电,则该化合物中一定含有离子键
过氧化氢(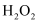 )被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法错误的是( )
)被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法错误的是( )
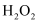 )被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法错误的是( )
)被称为绿色氧化剂,其分子结构如图所示。两个氢原子位于不重合的两个平面上,两个氧原子位于两平面的交线上。下列有关说法错误的是( )
A . 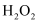 既有氧化性又有还原性
B . 过氧化氢分子中含有H—H键、O—O键
C . 过氧化氢分子的电子式为
既有氧化性又有还原性
B . 过氧化氢分子中含有H—H键、O—O键
C . 过氧化氢分子的电子式为 D . 过氧化氢分子中存在极性共价键和非极性共价键
D . 过氧化氢分子中存在极性共价键和非极性共价键
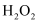 既有氧化性又有还原性
B . 过氧化氢分子中含有H—H键、O—O键
C . 过氧化氢分子的电子式为
既有氧化性又有还原性
B . 过氧化氢分子中含有H—H键、O—O键
C . 过氧化氢分子的电子式为最近更新



