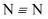е…ұд»·й”®зҡ„еҪўжҲҗеҸҠе…ұд»·й”®зҡ„дё»иҰҒзұ»еһӢ зҹҘиҜҶзӮ№йўҳеә“
-
пјҲ1пјү еұһдәҺзҰ»еӯҗеҢ–еҗҲзү©зҡ„жҳҜпјӣ
-
пјҲ2пјү еұһдәҺе…ұд»·еҢ–еҗҲзү©зҡ„жҳҜпјӣ
-
пјҲ3пјү еҗ«жңүзҰ»еӯҗй”®зҡ„зү©иҙЁжҳҜпјӣ
-
пјҲ4пјү ж—ўеҗ«жңүе…ұд»·й”®еҸҲеҗ«жңүзҰ»еӯҗй”®зҡ„зү©иҙЁжҳҜпјҺпјҲз”ЁеәҸеҸ·еЎ«з©әпјү
в‘ зҰ»еӯҗеҢ–еҗҲзү©дёҖе®ҡеҗ«зҰ»еӯҗй”®пјҢд№ҹеҸҜиғҪеҗ«жһҒжҖ§й”®жҲ–йқһжһҒжҖ§й”®
в‘ЎиӢҘжҷ¶дҪ“дёӯжңүйҳізҰ»еӯҗпјҢеҲҷдёҖе®ҡд№ҹеҗ«жңүйҳҙзҰ»еӯҗ
в‘ўеҗ«йҮ‘еұһе…ғзҙ зҡ„еҢ–еҗҲзү©дёҚдёҖе®ҡжҳҜзҰ»еӯҗеҢ–еҗҲзү©
в‘Јз”ұйқһйҮ‘еұһе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү©
в‘Өз”ұеҲҶеӯҗз»„жҲҗзҡ„зү©иҙЁдёӯдёҖе®ҡеӯҳеңЁе…ұд»·й”®
в‘ҘзҶ”иһҚзҠ¶жҖҒиғҪеҜјз”өзҡ„зү©иҙЁдёҖе®ҡжҳҜзҰ»еӯҗеҢ–еҗҲзү©
в‘ҰеҶ°зҶ”еҢ–ж—¶ж°ҙеҲҶеӯҗдёӯе…ұд»·й”®еҸ‘з”ҹж–ӯиЈӮ


 гҖҒ
гҖҒ  гҖҒ
гҖҒ  дёӯпјҢжүҖжңүеҺҹеӯҗйғҪж»Ўи¶іжңҖеӨ–еұӮ8з”өеӯҗзҡ„зЁіе®ҡз»“жһ„
B . еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯйҮ‘еұһе’ҢйқһйҮ‘еұһдәӨз•ҢеӨ„еҸҜд»ҘжүҫеҲ°еҚҠеҜјдҪ“жқҗж–ҷ
C . з”ұйқһйҮ‘еұһе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү©
D . з¬¬в… Aж—Ҹе…ғзҙ е’Ң第в…ҰAж—Ҹе…ғзҙ зҡ„еҺҹеӯҗд№Ӣй—ҙйғҪиғҪеҪўжҲҗзҰ»еӯҗй”®
дёӯпјҢжүҖжңүеҺҹеӯҗйғҪж»Ўи¶іжңҖеӨ–еұӮ8з”өеӯҗзҡ„зЁіе®ҡз»“жһ„
B . еңЁе…ғзҙ е‘ЁжңҹиЎЁдёӯйҮ‘еұһе’ҢйқһйҮ‘еұһдәӨз•ҢеӨ„еҸҜд»ҘжүҫеҲ°еҚҠеҜјдҪ“жқҗж–ҷ
C . з”ұйқһйҮ‘еұһе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү©
D . з¬¬в… Aж—Ҹе…ғзҙ е’Ң第в…ҰAж—Ҹе…ғзҙ зҡ„еҺҹеӯҗд№Ӣй—ҙйғҪиғҪеҪўжҲҗзҰ»еӯҗй”®
-
пјҲ1пјү иҜҘе…ғзҙ зҡ„еҹәжҖҒеҺҹеӯҗжңүдёӘиғҪеұӮе……жңүз”өеӯҗпјӣ
-
пјҲ2пјү еҶҷеҮәAеҺҹеӯҗзҡ„з”өеӯҗжҺ’еёғејҸе’Ңе…ғзҙ з¬ҰеҸ·пјӣгҖӮ
-
пјҲ3пјү жҢҮеҮәе…ғзҙ AеңЁе‘ЁжңҹиЎЁдёӯзҡ„дҪҚзҪ®гҖӮ
-
пјҲ4пјү жҢҮеҮәе…ғзҙ Aзҡ„жңҖй«ҳеҢ–еҗҲд»· гҖӮ
-
пјҲ5пјү Aзҡ„ж°ўеҢ–зү©еҲҶеӯҗдёӯе…ұд»·й”®зҡ„зұ»еһӢеҸҜиғҪжңүгҖӮ
в‘ s-pПғй”® в‘Ў p-pПғй”® в‘ў s-s Пғй”® в‘Ј p-pПҖй”®
-
пјҲ6пјү еҶҷеҮәдёҺAеҗҢе‘ЁжңҹжңӘжҲҗеҜ№з”өеӯҗж•°жңҖеӨҡзҡ„е…ғзҙ еҺҹеӯҗзҡ„д»·еұӮз”өеӯҗжҺ’еёғејҸгҖӮ
в‘ йқһйҮ‘еұһе…ғзҙ еҸҜиғҪжңүиҝҳеҺҹжҖ§пјҢд№ҹеҸҜиғҪжңүж°§еҢ–жҖ§пјӣв‘ЎйқһйҮ‘еұһе…ғзҙ еҸӘиғҪеҪўжҲҗе…ұд»·еҢ–еҗҲзү©пјӣв‘ўйҮ‘еұһйҳізҰ»еӯҗиў«иҝҳеҺҹдёҚдёҖе®ҡеҫ—еҲ°йҮ‘еұһеҚ•иҙЁпјӣв‘ЈйҮ‘еұһе…ғзҙ дёҚеҸҜиғҪеӯҳеңЁдәҺйҳҙзҰ»еӯҗдёӯпјӣ
в‘ӨйҮ‘еұһе…ғзҙ дёҺйқһйҮ‘еұһе…ғзҙ еҪўжҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜзҰ»еӯҗеҢ–еҗҲзү©
иЎЁдёҖ
| еҲҶеӯҗ | зҶ”зӮ№/в„ғ | жІёзӮ№/в„ғ | еёёжё©ж—¶еңЁж°ҙдёӯжә¶и§ЈеәҰ |
| CO | -205.05 | -191.49 | 2.3mL |
| N2 | -210.00 | -195.81 | 1.6mL |
иЎЁдәҢ
| CO | C-O | C=O | |
| й”®иғҪ(kJ /mol) | 357.7 | 798.9 | 1071.9 |
| N2 | N-N | N=N | |
| й”®иғҪ(kJ /mol) | 193 | 418 | 946 |
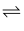
 пјӢ2Clп№Ј
пјӢ2Clп№Ј
 B .
B .  C .
C . 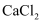 D .
D . 

 (з”ЁRд»ЈиЎЁ)пјҢз»ҸXе°„зәҝиЎҚе°„жөӢеҫ—еҢ–еҗҲзү©Rзҡ„жҷ¶дҪ“з»“жһ„пјҢе…¶еұҖйғЁз»“жһ„еҰӮеӣҫжүҖзӨәгҖӮд»Һз»“жһ„и§’еәҰеҲҶжһҗпјҢRдёӯдёӨз§ҚйҳізҰ»еӯҗдёҚеҗҢд№ӢеӨ„дёәпјҲ пјү
(з”ЁRд»ЈиЎЁ)пјҢз»ҸXе°„зәҝиЎҚе°„жөӢеҫ—еҢ–еҗҲзү©Rзҡ„жҷ¶дҪ“з»“жһ„пјҢе…¶еұҖйғЁз»“жһ„еҰӮеӣҫжүҖзӨәгҖӮд»Һз»“жһ„и§’еәҰеҲҶжһҗпјҢRдёӯдёӨз§ҚйҳізҰ»еӯҗдёҚеҗҢд№ӢеӨ„дёәпјҲ пјү