中和热 知识点题库
下列说法正确的是( )
A . 在101 kPa时,1 mol H2完全燃烧生成气态水,放出285.8 kJ热量,H2的燃烧热为285.8 kJ•mol﹣1
B . 测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C . 在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ•mol﹣1
D . 在稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ•mol﹣1 . 若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
0.50L 2.00mol/L H2SO4与2.00L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为 其表示中和热的热化学方程式为
(1)已知20.0gNaOH稀溶液跟足量稀盐酸反应,放出28.68kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量 kJ,由此测得的中和热为 kJ/mol.
(2)已知断开1molH﹣H键、1mol Br﹣Br键、1mol H﹣Br键分别需要吸收的能量为436kJ、193kJ、366kJ. 计算H2和Br2反应生成1mol HBr需 (填“吸收”或“放出”)能量 kJ.
下列说法正确的是( )
A . 甲烷燃烧热的数值为890.3kJ•mol﹣1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ•mol﹣1
B . 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的中和热为57.4kJ/mol
C . 相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
D . 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同
已知下列热化学方程式:
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJ•mol﹣1
③  H2SO4(1)+NaOH(1)═
H2SO4(1)+NaOH(1)═  Na2SO4(1)+H2O(1)△H=﹣57.3kJ•mol﹣1
Na2SO4(1)+H2O(1)△H=﹣57.3kJ•mol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJ•mol﹣1
⑤CO(g)+  O2(g)═CO2(g)△H=﹣283kJ•mol﹣1
O2(g)═CO2(g)△H=﹣283kJ•mol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJ•mol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJ•mol﹣1
-
(1) 上述热化学方程式中,不正确的有,不正确的理由分别是.
-
(2) 根据上述信息,写出C转化为CO的热化学方程式:.
-
(3) 上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有
下列关于中和热的说法中正确的是( )
A . 10 L 0.05 mol•L﹣1Ba(OH)2溶液与20 L 0.05 mol•L﹣1 HNO3反应时的反应热是中和热
B . 1 mol HCl气体通入1 L 0.01 mol•L﹣1 NaOH溶液中反应时的反应热是中和热
C . 1 mol HClO与2 mol NaOH溶液反应时的反应热也可能是中和热
D . 只要强酸与强碱在稀溶液中反应生成1 mol水时的反应热就是中和热
下列有关中和热的说法正确的是( )
A . 中和热的热化学方程式:H+(l)+OH﹣(l)═H2O(l)△H=﹣57.3 kJ/mol
B . 准确测量中和热的实验过程中,至少需测定温度4次
C . 环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小
D . 若稀酸溶液中H+与稀碱溶液中OH﹣的物质的量相等,则所测中和热数值更准确
根据问题填空:
-
(1) 已知20.0gNaOH稀溶液跟足量稀盐酸反应,放出28.68kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量kJ,由此测得的中和热为kJ/mol.
-
(2) 已知断开1molH﹣H键、1mol Br﹣Br键、1mol H﹣Br键分别需要吸收的能量为436kJ、193kJ、366kJ. 计算H2和Br2反应生成1mol HBr需(填“吸收”或“放出”)能量kJ.
下列有关热化学方程式及其叙述正确的是( )
A . 已知S(g)+O2(g)═SO2(g)△H1;S(s)+O2(g)═SO2(g)△H2 , 则△H1<△H2
B . HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
C . 已知C(石墨,s)=C(金刚石,s)ΔH>0,则金刚石比石墨稳定
D . 氢气的燃烧热为285.5 kJ·mol-1 , 则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)ΔH=+285.5 kJ·mol-1
下列有关能量的判断和表示方法正确的是( )
A . 由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ,可知:金刚石比石墨更稳定
B . 等质量的硫蒸气和硫固体分别完全燃烧,前者放出的热量更多
C . 由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ
D . 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ
下列有关能量的判断和表示方法正确的是( )
A . 由C(s,石墨)=C(s,金刚石) ΔH=+1.9 kJ,可知:石墨比金刚石更稳定
B . 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C . 由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ/mol,可知:含1 mol/L CH3COOH的溶液与含1 mol/L NaOH的溶液混合,放出热量小于57.3 kJ
D . 2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为H2(g)+1/2O2(g) =H2O(l) ΔH=-285.8 kJ/mol
-
(1) 已知C(s,石墨)=C(s,金刚石) ΔH>0,则稳定性:金刚石石墨(填“>”或“<”)。
-
(2) 已知:2C(s)+2O2(g)=2CO2(g) ΔH1 2C(s)+O2(g)=2CO(g) ΔH2
则ΔH1ΔH2(填“>”或“<”)。
-
(3) “嫦娥五号”预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。用肼(N2H4)作燃料,四氧化二氮作氧化剂,二者反应生成氮气和气态水。已知:
①N2(g)+2O2(g)=N2O4(g) ΔH=+10.7 kJ·mol-1
②N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:。
-
(4) 25℃、101 kPa时,14 g CO在足量的O2中充分燃烧,放出141.3 kJ热量,则CO的燃烧热为ΔH=。
-
(5) 0.50 L 2.00 mol·L-1H2SO4溶液与2.10 L 1.00 mol·L-1 KOH溶液完全反应,放出114.6 kJ热量,该反应的中和热ΔH=。
-
(6) 已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式是。
下列关于热化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热△H=-57.3 kJ·mol−1 , 则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol−1
B . 甲烷的标准燃烧热ΔH=-890.3 kJ·mol−1 , 则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol−1
C . 已知:500℃、30MPa下,N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D . CO(g)的燃烧热是283.0kJ·mol−1 , 则2CO2(g) =2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−1
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D . CO(g)的燃烧热是283.0kJ·mol−1 , 则2CO2(g) =2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−1
 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D . CO(g)的燃烧热是283.0kJ·mol−1 , 则2CO2(g) =2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−1
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D . CO(g)的燃烧热是283.0kJ·mol−1 , 则2CO2(g) =2CO(g)+O2(g)反应的△H=+566.0 kJ·mol−1
下列叙述正确的是( )
A . 甲烷的燃烧热:∆H=-890.3kJ
B . 碳生成一氧化碳的燃烧热是111kJ/mol
C . 中和热 ∆H=-57.3kJ/mol
D . 醋酸与NaOH反应的中和热小于-57.3kJ/mol
下列说法或表示方法中正确的是( )
A . 相同条件下,等质量的硫蒸气和硫固体分别完全燃烧,反应的热效应△H1>△H2
B . 由C(石墨)→C(金刚石)△H=+1.9kJ/mol,可知金刚石比石墨稳定
C . 已知在101KPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量.则有关氢气燃烧热的热化学方程式为:2H2(g)+O2(g)═2H2O(l)△H=+285.8kJ/mol
D . 在稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol,若将含0.5 mol硫酸的浓硫酸与含1 molNaOH的溶液混合,放出的热量大于57.3 kJ
下列说法正确的是( )
A . 在稀溶液中,1molH2SO4(aq)与1molBa(OH)2(aq)完全中和所放出的热量为中和热
B . 25℃、101kPa时,CH3OH(l)和CH3OH(g)的燃烧热不相等
C . 20gBa(OH)2·8H2O粉末与10gNH4Cl晶体混合搅拌,放出氨气,该反应是放热反应
D . 燃烧热随热化学方程式中物质前的化学计量数的改变而改变
在下列说法中正确的是( )
A . 需要加热才能发生的反应一定是吸热反应
B . 热化学方程式中的化学计量数可以是分数
C . 1mo1酸与1mol碱反应放出的热叫作中和热
D . 石墨转化为金刚石的过程中没有热量变化
下述描述中,正确的是( )
A . 已知:2CO(g)+O2(g)=2CO2(g)∆H=-566 kJ/mol,N2(g)+O2(g)=2NO(g) ∆H=+180 kJ/mol,则2CO(g)+2NO(g)=N2(g)+2CO2(g) ∆H=−746kJ/mol
B . 由CH3(CH2)2CH3(g)+13/2O2(g)=4CO2(g)+5H2O(g) ∆H=-2658 kJ/mol可知,正丁烷标准燃烧热为2658 kJ/mol
C . OH—(aq)+H+(aq)=H2O(l) ∆H=-57.3 kJ/mol,故1mol醋酸与1molNaOH完全反应,放出的热量一定为57.3kJ
D . 已知P4(白磷,s)=4P(红磷,s) ∆H<0,则白磷比红磷稳定
实验室利用如图装置进行中和热的测定,请回答下列问题:

-
(1) 从实验装置上看,图中尚缺少的玻璃用品是,装置中还存在的不正确为,这种不正确会造成最高温度读数(填“偏大”、“偏小”或“无影响”)。
-
(2) 在操作正确的前提下,提高中和热测定准确性的关键是。
-
(3) 把温度为13℃,浓度为
 的酸溶液和
的酸溶液和 的碱溶液各50mL混合[溶液密度均为
的碱溶液各50mL混合[溶液密度均为 , 生成溶液的比热容
, 生成溶液的比热容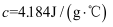 ],轻轻搅动,测得酸碱混合液的温度变化数据如表:
],轻轻搅动,测得酸碱混合液的温度变化数据如表:反应物
起始温度
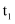 /℃
/℃终了温度
 /℃
/℃中和热

13



13


①计算上述两组实验测出的中和热:提示。
 ;
;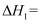
 ;
;
 。
。②两组实验结果差异的原因是。
③根据实验结果写出氢氧化钠溶液与盐酸反应的热化学方程式:。
下列说法正确的是( )
A . 测定中和反应反应热的实验中,可用铜丝代替环形玻璃搅拌棒
B . 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) △H= -114.8 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全反应,放出的热量为57.4 kJ
C . 升高温度,反应速率加快,主要原因是活化分子的百分数增加
D . 2C(s)+O2(g)=2CO(g) △H= -221kJ/mol,则碳的燃烧热为-110.5 kJ/mol
最近更新



