中和热 知识点题库
下列有关叙述正确的是( )
A . 如图所示,测定中和热时,大小两烧杯间填满碎纸的作用只是固定小烧杯 B . 若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.25mo1·L-1的硫酸充分反应,两反应测定的中和热不相等
C . 在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润 洗,再加进标准液
D . 进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
B . 若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.25mo1·L-1的硫酸充分反应,两反应测定的中和热不相等
C . 在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润 洗,再加进标准液
D . 进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
 B . 若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.25mo1·L-1的硫酸充分反应,两反应测定的中和热不相等
C . 在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润 洗,再加进标准液
D . 进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
B . 若用50mL 0.55mo1·L-1的氢氧化钠溶液,分别与50mL 0.50mo1·L-1的盐酸和50mL 0.25mo1·L-1的硫酸充分反应,两反应测定的中和热不相等
C . 在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润 洗,再加进标准液
D . 进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
下列依据热化学方程式得出的结论正确的是( )
A . 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=﹣57.3 kJ•mol﹣1 , 则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B . 已知2H2(g)+O2(g)=2H2O(g)△H=﹣483.6 kJ•mol﹣﹣1 , 则氢气的燃烧热为241.8kJ•mol﹣1
C . 已知2C(s)+2O2(g)=2CO2(g)△H=a 2C(s)+O2(g)=2CO(g)△H=b,则a>b
D . 已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定
下列说法正确的是( )
A . 1mol H2SO4与 1mol Ba(OH)2完全反应放出的热量叫做中和热
B . 等物质的量强酸和弱酸分别与等量的烧碱反应生成等量的水,弱酸反应放出的热量比强酸少
C . CO能继续与O2反应生成稳定的氧化物CO2 , 所以说CO与O2的反应是吸热反应
D . 在101kPa时,1mol C燃烧时放出的热量为C的燃烧热
25℃、101kPa时,强酸与强碱的稀溶液中发生中和反应的中和热为57.3kJ•mol﹣1 , 则下列对中和热的描述正确的是( )
A . 2KOH(aq)+H2SO4(aq)═K2SO4(aq)+2H2O(1)△H=﹣114.6 kJ•mol﹣1此时中和热△H=﹣114.6 kJ•mol﹣1
B . NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(1)△H=+57.3 kJ•mol﹣1
C . H2SO4和NaOH反应的中和热△H=﹣57.3 kJ•mol﹣1
D . 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量
运用中和反应反应热的测定方法,即保温、隔热的条件下,向盛有20mL 2.08mol/L NaOH溶液的试管中分五次加入1~5mL未知浓度的H2SO4溶液(边加边振荡,每次加入1mL)后,测得溶液的温度分别是1.4℃、2.5℃、4.2℃、5.2℃、5.18℃,则该硫酸溶液的物质的量浓度约是( )
A . 20.8 mol/L
B . 6.9 mol/L
C . 5.2 mol/L
D . 4.16 mol/L
1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为,表示该中和热的热化学方程式为.
已知H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1 . 以下四个化学方程式其中反应热为57.3kJ•mol﹣1的是( )
①H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)═BaSO4(s)+2H2O(l)
③HCl(aq)+NH3•H2O(aq)═NH4Cl(aq)+H2O(l)
④CH3COOH(aq)+NH3•H2O(aq)═CH3COONH4(aq)+H2O(l)
A . ①和②
B . ③
C . ④
D . 以上都不对
已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的△H= -55.6kJ·mol-1。则HCN在水溶液中电离的△H等于( )
A . -67.7 kJ·mol-1
B . -43.5 kJ·mol-1
C . +43.5kJ·mol-1
D . +67.7kJ·mol-1
下列有关热化学方程式的叙述正确的是( )
A . 已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ
B . 已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
C . 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+  H2SO4(aq)=
H2SO4(aq)=  Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
D . 已知C(s)+O2(g)=CO2(g);△H1 C(s)+
Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
D . 已知C(s)+O2(g)=CO2(g);△H1 C(s)+  O2(g)=CO(g);△H2 则△H1>△H2
O2(g)=CO(g);△H2 则△H1>△H2
 H2SO4(aq)=
H2SO4(aq)=  Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
D . 已知C(s)+O2(g)=CO2(g);△H1 C(s)+
Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
D . 已知C(s)+O2(g)=CO2(g);△H1 C(s)+  O2(g)=CO(g);△H2 则△H1>△H2
O2(g)=CO(g);△H2 则△H1>△H2
在测定中和热的实验中,下列说法正确的是( )
A . 使用环形玻璃棒是为了加快反应速率,减小实验误差
B . 为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C . 用0.5mol•L﹣1NaOH溶液分别与0.5 mol•L﹣1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D . 在测定中和热实验中需要使用的仪器有:天平、量筒、烧杯、滴定管、温度计
已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) △H=-221kJ/mol;
②稀溶液中,H+(aq)+OH-(aq)=H2O(l),△H=-57.3kJ/mol。
下列结论正确的是()
A . 反应①的反应热为221kJ
B . 碳的燃烧热为△H=-221kJ/mol
C . 稀硫酸与稀NaOH溶液反应的中和热为△H=-57.3kJ/mol
D . 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
下列关于反应热的描述中正确的是( )
A . CO(g)的燃烧热283.0kJ·mol-1 , 则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ·mol-1
B . HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1 , 则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
C . 反应热有正负之分,燃烧热ΔH全部是正值
D . 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
下列说法正确的是( )
A . Ba(OH)2·8H2O与NH4Cl的反应、铝片与稀盐酸的反应都是放热反应
B . 酸、碱稀溶液的中和热方程式可表示为:H+(aq)+OH-(aq)=H2O(1) ΔH= - 57.3kJ·mol-1
C . 由C(s,石墨)→C(s,金刚石)ΔH=+1.9kJ·mol-1可知,金刚石比石墨稳定
D . 催化剂的使用对化学反应的反应热(ΔH)不产生影响
下列说法正确的是( )
A . 任何酸与碱发生中和反应生成1molH2O的过程中,能量变化均相同
B . 已知:① C(s石墨)+O2(g)=CO2(g) △H1=-393.5 kJ/mol② C(s金刚石)+O2(g)=CO2(g) △H2=-395.0 kJ/mol,则金刚石比石墨稳定
C . 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH相同
D . 表示硫的燃烧热的热化学方程式:S(s) +3/2O2(g)=SO3(g);△H=-315kJ/mol
下列有关热化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热 ΔH=2×(-57.3)kJ/mol
B . CO(g)的燃烧热是-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=(2×283.0)kJ/mol
C . 1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D . 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
下列有关热化学方程式的叙述正确的是( )
A . 已知2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,则C的燃烧热为110.5kJ/mol
B . 已知3O2(g)= 2O3(g) △H=+242.4kJ•mol-1 , 则臭氧比氧气稳定
C . 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol
D . 甲烷的标准燃烧热△H=-890.3 kJ•mol-1 , 则CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H<-890.3 kJ•mol-1
下列说法中正确的是( ΔH的绝对值均正确)( )
A . 热值指在一定条件下单位质量的物质完全燃烧所放出的热量,则CO热值为10.1kJ/g
B . 已知稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,则稀醋酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ/mol
C . C2H5OH的燃烧热C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-1367.0kJ/mol
D . N2+2O2=2NO2 ΔH=67.8kJ/mol
下列说法或表示方法正确的是( )
A . 由C(石墨)= C(金刚石);△H=+1.90 kJ/mol可知,金刚石比石墨稳定
B . 等物质的量的固体硫和硫蒸气分别完全燃烧,后者放出热量多
C . 在101kPa时,2g氢气完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)= 2H2O(l);△H=-285.8kJ/mol
D . 在稀溶液中,H+(aq)+ OH-(aq) = H2O(l);△H=-57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
下列说法错误的是( )
A . HCl和NaOH反应的中和热  ,则
,则  和
和 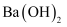 反应生成1mol
反应生成1mol  时对应的
时对应的 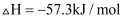 B . 需要加热才能发生的反应可能是放热反应
C . 0.1mol氮气和0.3mol氢气,在密闭容器中充分反应生成氨气,转移的电子数小于0.6
B . 需要加热才能发生的反应可能是放热反应
C . 0.1mol氮气和0.3mol氢气,在密闭容器中充分反应生成氨气,转移的电子数小于0.6  D . 水中的钢闸门连接电源的负极来防腐是采用了外加电流的阴极保护法
D . 水中的钢闸门连接电源的负极来防腐是采用了外加电流的阴极保护法
 ,则
,则  和
和 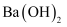 反应生成1mol
反应生成1mol  时对应的
时对应的 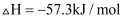 B . 需要加热才能发生的反应可能是放热反应
C . 0.1mol氮气和0.3mol氢气,在密闭容器中充分反应生成氨气,转移的电子数小于0.6
B . 需要加热才能发生的反应可能是放热反应
C . 0.1mol氮气和0.3mol氢气,在密闭容器中充分反应生成氨气,转移的电子数小于0.6  D . 水中的钢闸门连接电源的负极来防腐是采用了外加电流的阴极保护法
D . 水中的钢闸门连接电源的负极来防腐是采用了外加电流的阴极保护法
下列有关反应热的说法正确的是( )
A .  与
与 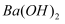 溶液反应放出热量
溶液反应放出热量 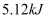 ,则该中和反应的
,则该中和反应的  B . 盐酸和
B . 盐酸和 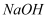 溶液中和反应的热化学方程式:
溶液中和反应的热化学方程式:  C . 在稀溶液中,强酸与强碱反应生成
C . 在稀溶液中,强酸与强碱反应生成  的反应热
的反应热  ,若将含有
,若将含有  的浓硫酸和含有
的浓硫酸和含有  的溶液混合,放出的热量大于
的溶液混合,放出的热量大于 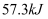 D .
D .  的燃烧热为
的燃烧热为 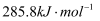 ,则反应
,则反应  的
的 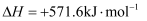
 与
与 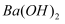 溶液反应放出热量
溶液反应放出热量 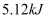 ,则该中和反应的
,则该中和反应的  B . 盐酸和
B . 盐酸和 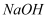 溶液中和反应的热化学方程式:
溶液中和反应的热化学方程式:  C . 在稀溶液中,强酸与强碱反应生成
C . 在稀溶液中,强酸与强碱反应生成  的反应热
的反应热  ,若将含有
,若将含有  的浓硫酸和含有
的浓硫酸和含有  的溶液混合,放出的热量大于
的溶液混合,放出的热量大于 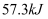 D .
D .  的燃烧热为
的燃烧热为 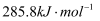 ,则反应
,则反应  的
的 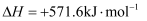
最近更新



