中和热 知识点题库
-
(1) 下列△H表示物质燃烧热的是;表示物质中和热的是 .
A.2H2(g)+O2(g)=2H2O(l);△H1
B.C(s)+
 O2(g)=CO(g);△H2
O2(g)=CO(g);△H2C.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H3
D.C(s)+O2(g)=CO2(g);△H4
E.C6H12O6(s)+12O2(g)=6CO2 (g)+6H2O (l);△H5
F.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H6
G.2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);△H7
H.CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);△H8
-
(2) 甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成SiO2和水.已知室温下10g甲硅烷自燃放出热量446kJ,表示其燃烧热的热化学方程式为 .
-
(3) 使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1molCl2参与反应时释放145kJ的热量,写出这个热化学方程式:.
①稀醋酸;②浓硫酸;③稀硝酸至恰好完全反应,并将上述过程中放出的热量分别记为Ql、Q2、Q3 .
下列关系式中正确的是( )
①H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)
③NH3•H2O(aq)+HCl(aq)=NH4Cl(aq)+H2O(l)
④NH3•H2O(aq)+CH3COOH(aq)=CH3COONH4(aq)+H2O(l)
其中反应热为57.3kJ/mol的是( )
②稀溶液中,H+(aq)+OH﹣(aq)=H2O(l)△H=﹣57.3kJ/mol
下列结论正确的是( )
②稀溶液,H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3kJ/mol
下列结论正确的是( )
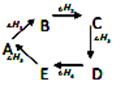 则热量变化关系式: △H1+△H3+△H5=-(△H2+△H4)
C . △H与反应方程式中的化学计量数,物质的状态和可逆反应均有关
D . 同温同压下, H2( g)+ Cl 2(g)= 2HCl (g)在光照和点燃条件下的△H不同
则热量变化关系式: △H1+△H3+△H5=-(△H2+△H4)
C . △H与反应方程式中的化学计量数,物质的状态和可逆反应均有关
D . 同温同压下, H2( g)+ Cl 2(g)= 2HCl (g)在光照和点燃条件下的△H不同
-
(1) 实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol/L盐酸、0.55 mol/L NaOH溶液,实验尚缺少的玻璃用品是、。
-
(2) 实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?(填“能”或“否”),其原因是。
-
(3) 他们记录的实验数据如表:
实验用品
溶液温度
中和热
t1
t2
ΔH
①
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.3 ℃
②
50 mL
0.55 mol/L
NaOH溶液
50 mL
0.5 mol/L
HCl溶液
20 ℃
23.5 ℃
已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ/(℃·kg),各物质的密度均为1 g/cm3。
①计算完成上表。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式:。
-
(4) 若用KOH代替NaOH,对测定结果
(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果(填“有”或“无”)影响。
 H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l);△H=+11.46kJ/mol
B . 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O(l);△H=-114.6kJ/mol
C . 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+H2O(l);△H=+114.6kJ/mol
D . KOH(aq)+
K2SO4(aq)+H2O(l);△H=+11.46kJ/mol
B . 2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O(l);△H=-114.6kJ/mol
C . 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+H2O(l);△H=+114.6kJ/mol
D . KOH(aq)+  H2SO4(aq)=
H2SO4(aq)=  K2SO4(aq)+H2O(l);△H=-57.3kJ/mol
K2SO4(aq)+H2O(l);△H=-57.3kJ/mol
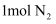 和
和 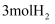 置于密闭容器中充分反应生成
置于密闭容器中充分反应生成 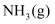 ,放热
,放热  ,其热化学方程式为
,其热化学方程式为 
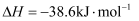 B .
B .  和
和  反应的中和热
反应的中和热  为
为  ,则
,则  和
和  反应的中和热也为
反应的中和热也为  C . 在101kPa时,
C . 在101kPa时,  完全燃烧生成液态水,放出
完全燃烧生成液态水,放出 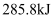 热量,表示
热量,表示  标准燃烧热的热化学方程式为
标准燃烧热的热化学方程式为 
 D .
D . 
 ,相同条件下,白磷比红磷稳定
,相同条件下,白磷比红磷稳定

 2NH3(g) △H= -38.6 kJ·mol-1
2NH3(g) △H= -38.6 kJ·mol-1
 的绝对值均符合题意)( )
的绝对值均符合题意)( )
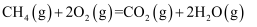
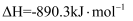 (燃烧热)
B .
(燃烧热)
B . 
 (中和热)
C .
(中和热)
C . 
 (反应热)
D .
(反应热)
D . 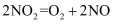
 (反应热)
(反应热)



