铁盐和亚铁盐的相互转变 知识点题库
实验操作 | 实验现象 | 离子反应 | 实验结论 | |
A | (1)在氯化亚铁溶液中滴加新制氯水 | 浅绿色溶液变成 黄色溶液 | 2Fe2++Cl2=2Fe3++2Cl﹣ | Fe2+具有还原性 |
B | (2)在氯化亚铁溶液中加入锌片 | 浅绿色溶液变成 无色溶液 | Fe2++Zn=Fe+Zn2+ | Zn具有还原性 |
C | (3)在氯化铁溶液中加入铁粉 | 黄色溶液变成 浅绿色 | Fe3++Fe=2Fe2+ | 铁单质具有还原性 |
D | (4)在氯化铁溶液中加入铜粉 | 蓝色溶液变成 黄色溶液 | 2Fe3++Cu=2Fe2++Cu2+ | Fe3+具有氧化性 |
其中符合实验要求而且完全正确的是( )
Ⅰ.配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉.
Ⅱ.实验探究Fe3+与Fe2+的相互转化
实验1:0.1 mol/L FeCl2溶液  无明显现象
无明显现象  溶液变红
溶液变红
实验2:0.1 mol/L FeCl3溶液  溶液变红
溶液变红  溶液红色未褪去
溶液红色未褪去
-
(1) 写出Fe(OH)2Cl与盐酸反应的离子方程式.
-
(2) 请用离子方程式解释实验1中滴加氯水后溶液变红的原因.
-
(3) 实验2的现象与预测不同,为探究可能的原因,该小组同学又进行了如下实验:
步骤1:10 mL 0.1 mol/L KI溶液
 溶液明显变黄
溶液明显变黄步骤2:将黄色溶液分为三份.
试管1 取2 mL 黄色溶液
 溶液变红
溶液变红试管2 取3 mL 黄色溶液
 溶液变蓝
溶液变蓝试管3 取3 mL 黄色溶液
 取上层溶液
取上层溶液  溶液变蓝
溶液变蓝(比试管2中溶液颜色深)
①试管2中滴加K3[Fe(CN)6]检验的离子是.
②黄色溶液中含有的溶质微粒有K+、Cl﹣和.
③综合上述实验现象,得出的实验结论是.


请回答下列问题:
-
(1) 加入足量稀盐酸后,发生化学反应的类型有_____________(填写代号)。A . 氧化还原反应 B . 化合反应 C . 分解反应 D . 复分解反应
-
(2) 加入适量氯水的作用是.
-
(3) 写出灼烧红褐色沉淀时发生反应的化学方程式。实验室灼烧红褐色沉淀可选用的装置是(填序号)。

-
(4) 若向黄色溶液中加入过滤①后的滤渣,发生反应的离子方程式为。
-
(5) 检验黄色溶液中Fe3+是否完全沉淀的方法是:取过滤②后的少量滤液于试管中,。
| 操作 | 现象 | 解释、结论 | |
| A | 过量的Fe粉中加入硝酸充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀硝酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | Al箔插入稀硝酸中 | 无现象 | Al在硝酸中钝化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
-
(1) 分别取一定量氯化铁、氯化亚铁固体,均配制成0.1mol/L的溶液。为防止Fe2+被氧化,FeCl2溶液中需加入。
-
(2) 甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的化学反应方程式为。
-
(3) 乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是。
-
(4) 丙组同学取10mL 0.1mol·L-1KI溶液,加入6mL0.1mol·L-1FeCl3溶液混合。分别取2mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是(填离子符号);写出KI与FeCl3反应的离子方程式
 B .
B .  C .
C . 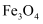 D .
D . 
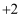 价和
价和  价两种价态,下列有关反应不涉及铁元素价态变化的是( )
价两种价态,下列有关反应不涉及铁元素价态变化的是( )
 是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含
是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含  、
、  、
、  、
、 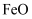 等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。
等物质)。某课题组以此粉末为原料,设计如下流程对资源进行回收,得到纯净的和硫酸铁铵晶体。 
已知:  不溶于稀硫酸,也不溶于
不溶于稀硫酸,也不溶于  溶液。
溶液。
回答下列问题:
-
(1) 废玻璃粉末与稀硫酸充分反应后,过滤要用到的玻璃仪器有玻璃棒、;“操作X”是将溶液1、过滤、洗涤、干燥得到硫酸铁铵晶体。
-
(2) 向滤液1中加入稀硫酸、
 溶液的目的是。滤渣1中加稀硫酸和溶液发生反应的离子方程式为。
溶液的目的是。滤渣1中加稀硫酸和溶液发生反应的离子方程式为。
-
(3) 要证明滤液1中含有
 ,可选用的试剂为。
,可选用的试剂为。
-
(4) 由滤液2生成
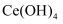 的离子方程式为。
的离子方程式为。
-
(5) 取上述流程中得到的
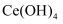 产品
产品  ,加硫酸溶解后,用浓度为
,加硫酸溶解后,用浓度为 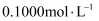 的
的 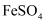 标准溶液滴定至终点时(铈元素被还原为
标准溶液滴定至终点时(铈元素被还原为  ),消耗
),消耗  标准溶液.该产品中
标准溶液.该产品中 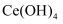 的质量分数为(结果保留两位有效数字)。
的质量分数为(结果保留两位有效数字)。

A的一种合金用量最大,用途最广。请回答下列问题:
-
(1) 在C中加入氢氧化钠溶液的现象:。
-
(2) B、H的化学式:B、H。
-
(3) Na2O2的电子式:。
-
(4) 写出鉴定E中阳离子的实验方法和现象:。
-
(5) 在C溶液中加入与C等物质的量的Na2O2 , 恰好使C转化为F,写出该反应的离子方程式:。
 、
、  、
、  和X四种离子以个数比
和X四种离子以个数比  大量共存于同一溶液中,X可能是( )
大量共存于同一溶液中,X可能是( )
 B .
B . 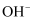 C .
C .  D .
D . 
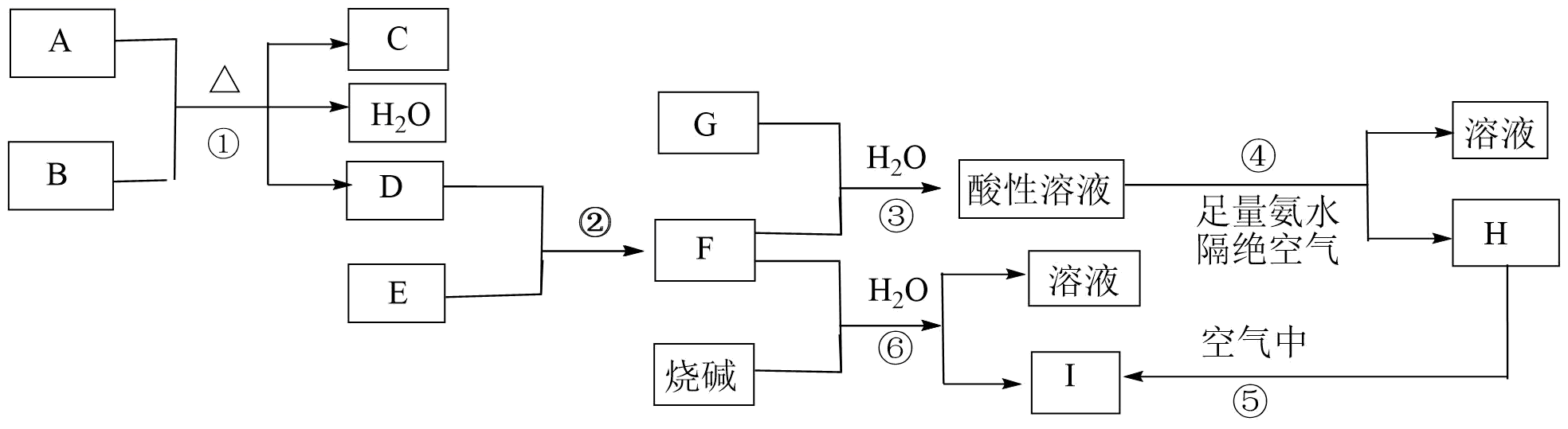
请回答下列问题:
-
(1) 推断出下列物质(用化学式作答):C,G。
-
(2) 请写出下列反应的方程式:反应①的离子方程式;反应③的离子方程式;反应⑤的化学方程式。
-
(3) 欲从反应⑥的体系中得到沉淀I的系列操作是、、恒温干燥(均填操作名称)。
-
(4) 实验室配制90 mL2 mol/L的烧碱溶液,需选用mL容量瓶。用托盘天平称取g烧碱。若定容时,俯视刻度线,配制的溶液的浓度(填“偏大”“偏小”或“无影响”)。
①金属钠在纯氧中燃烧
②FeSO4溶液中滴入NaOH溶液,并在空气中放置一段时间
③FeCl3溶液中滴入KSCN溶液
④无水硫酸铜放入医用酒精中

-
(1) 物质T的电子式为,T含有的化学键类型有;
-
(2) D和M在溶液中反应生成B的离子反应方程式为:;
-
(3) G在潮湿空气中变成H的实验现象是,化学方程式为。
-
(4) T和F反应只生成C、H和一种正盐,其离子反应方程式为:。
-
(5) 0.1 mol E和R的混合物,加盐酸后固体全部溶解,共收集到0.02 mol H2 , 且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中铁的物质的量百分数为。



