铁盐和亚铁盐的相互转变 知识点题库
-
(1) 甲同学的实验说明FeCl3溶液和KI溶液发生的反应,用离子方程式表示.
-
(2) 乙同学在实验中观察不到甲同学的实验现象,其原因分析合理的是 .A . Fe3+被F﹣还原成Fe2+ , 使溶液中不再存在Fe3+ B . Fe3+与F﹣结合成难电离物质,不再和I﹣反应 C . I﹣和F﹣或I﹣与NH4+结合成难电离物质,不再和Fe3+反应
-
(3) 乙同学所用的NH4F溶液是用塑料瓶盛装的,可否改用玻璃试剂瓶(填写能与否)其原因是.
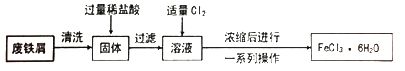
请回答下列问题。
-
(1) 固体中加入过量稀盐酸时的现象是。
-
(2) 溶液中通入Cl2时发生反应的化学方程式是,反应中Cl2表现出的性质是,此处的Cl2也可以用代替(填序号)。
A.H2O2 B.SO2 C.浓硫酸
-
(3) 上述流程中由浓缩后的溶液获取FeCl3·6H2O的操作包括、过滤、洗涤。
-
(4) 用FeCl3溶液制备Fe2O3 , 可向FeCl3溶液中滴加足量,然后过滤、洗涤、,即可得到Fe2O3。
-
(5) FeCl3溶液能用作印制电路铜板的腐蚀液,FeCl3溶液与铜反应的离子方程式是,反应一段时间后,取少量腐蚀液,向其中滴加,观察到,证明腐蚀液中任含Fe3+。此时腐蚀液中的金属阳离子是。

请回答下列问题:
-
(1) 写出下列物质的化学式:B、丙、乙.
-
(2) 写出下列反应的离子方程式:
反应①;
反应⑤;
反应⑥.
-
(3) 将0.4g D和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol•L﹣1稀盐酸.在如图2所示的坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图象.
-
(4) 将18.4 g D 和NaHCO3固体混合物,在密闭容器中加热到约250℃,经充分反应后排出气体,冷却,称得剩余固体质量为16.6 g。试计算混合物中NaOH的质量分数。(请写出计算过程)
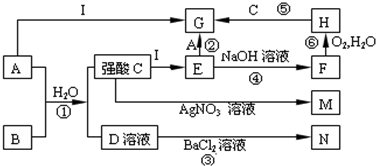
-
(1) 写出①的化学方程式。
-
(2) 写反应②的离子方程式。
-
(3) 写出将A通入石灰乳的化学方程式。
-
(4) 在①→⑥中,属于氧化还原反应的有(填编号)
-
(5) 将NaOH溶液加入到E中的现象为。
-
(6) 写出反应⑥的化学反应方程式。
-
(7) 写出分别将A、B通入石蕊试液中的现象:
AB。
-
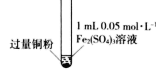
(1) 加入铁粉后发生反应的离子反应方程式为。
-
(2) 充分反应后,溶液中存在4.8g不溶物的成分为。
-
(3) 充分反应后溶液中一定不存在的金属离子为,一定存在的金属离子是。
-
(4) 由Cu+2FeCl3=CuCl2+2FeCl2知,溶液中离子氧化性Fe3+Cu2+(填“大于”、“等于”、“小于”)。
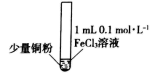
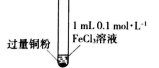
| 序号 | I | II | III |
| 实验步骤 | 充分振荡,加入2mL蒸馏水 | 充分振荡,加入2mL蒸馏水 | 充分振荡,加入2mL蒸馏水 |
| 实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法错误的是( )
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2 与空气中的CO2反应生成CaCO3 |
C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
D | FeCl3溶液可用于铜质印刷线路板制作 | FeCl3能从含有Cu2+的溶液中置换出铜 |
| 选项 | 实验操作和现象 | 预期实验目的或结论 |
| A | 用洁净的铂丝蘸取某食盐试样,在酒精灯火焰上灼烧,火焰显黄色 | 说明该食盐试样不含KIO3 |
| B | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
| C | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和AgNO3溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡: |
| D | 室温下向CuCl2和少量FeCl3的混合溶液中,加入铜屑,充分搅拌,过滤,得蓝绿色溶液 | 除去杂质FeCl3得纯净CuCl2溶液 |
![]()
-
(1) 写出FeCl3溶液与铜箔发生反应的离子方程式:。
-
(2) 检验废腐蚀液中是否含有Fe3+所需试剂名称:,实验现象:。
-
(3) 向②中加入NaOH溶液并长时间暴露在空气中,此过程的现象:,此转化的化学方程式为:。
-
(4) 写出③中所含物质:,⑥发生反应的离子方程式:。
| 选项 | 物质(括号内为杂质) | 除杂试剂或物质 | 除杂操作 |
| A | Fe(Cu)固体 | 磁铁 | 吸引后弃去剩余固体 |
| B | FeCl2(FeCl3)溶液 | Fe | 加入过量 Fe 粉, 充分反应后过滤 |
| C | CO2(HCl)气体 | 饱和 NaHCO3 溶液、浓 H2SO4 | 依次充分洗气 |
| D | Na2CO3(NaHCO3)溶液 | CO2 | 通入过量 CO2 |
| 操作 | 现象 | 解释或结论 | |
| A | 甲苯与高锰酸钾溶液混合振荡 | 水层紫红色褪去 | 苯环对甲基有活化作用 |
| B | FeCl3、KI混合溶液中滴加KSCN溶液 | 溶液呈红色 | FeCl3不与KI反应 |
| C | 向氯化铜溶液中逐滴加入氨水 | 产生沉淀继而溶解 | 氢氧化铜有两性 |
| D | 向20%蔗糖溶液中加入少量稀硫酸,加热;再加入银氨溶液并水浴加热 | 未出现银镜 | 蔗糖未水解 |
| 选项 | 实验 | 现象 | 结论 |
| A | 相同温度下,用 | 测 | 相同温度下 |
| B | 取 | 溶液不变红 | 反应后固体中可能含有 |
| C | 将湿润的淀粉- | 试纸变蓝 | 该气体为 |
| D | 将少量 | 溶液呈血红色 | |
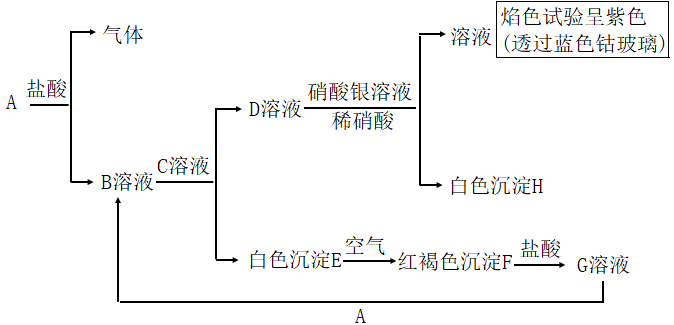
-
(1) 写出C和H的化学式:C;H 。
-
(2) 写出E转变成F的化学方程式:。
-
(3) 向G溶液中除加入A外,加入Cu也能生成B,写出G中加入Cu反应的离子方程式 。
-
(4) 向G溶液中加入一定量A后,为检验所得溶液中金属阳离子,甲、乙两位同学做了如下实验:甲同学取出少量反应后溶液,加入少量H2O2 , 再滴加几滴KSCN溶液,发现溶液显血红色,由此得出结论有Fe2+;乙同学取出少量反应后溶液,加入少量酸性KMnO4溶液,发现酸性KMnO4溶液褪色,由此得出结论有Fe2+。.丙同学看了实验过程后认为甲、乙同学的结论都有问题,你觉得丙同学判断甲、乙同学结论的依据是:。
 溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含
溶液作为“腐蚀液”将覆铜板上不想要的铜腐蚀,同时还可以从腐蚀废液(主要含 、
、 和
和 )中回收铜,并重新获得
)中回收铜,并重新获得 溶液。废液处理流程如下:
溶液。废液处理流程如下:
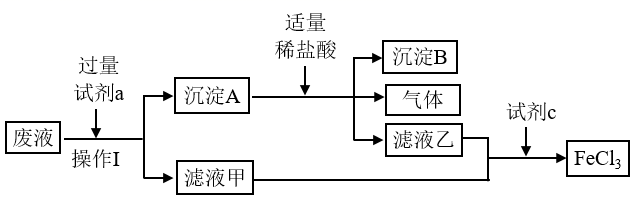
请回答下列问题。
-
(1) 操作
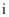 的名称为。
的名称为。
-
(2)
 溶液腐蚀铜板的离子方程式为。
溶液腐蚀铜板的离子方程式为。
-
(3) 试剂
 为(填化学式)。沉淀
为(填化学式)。沉淀 为(填化学式)。从氧化还原反应的角度分析,试剂
为(填化学式)。从氧化还原反应的角度分析,试剂 是剂。
是剂。
-
(4) 为了检验腐蚀废液中是否含有
 , 可将腐蚀废液取样然后滴加(填化学式)溶液。
, 可将腐蚀废液取样然后滴加(填化学式)溶液。
-
(5) 查阅资料可知
 能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,请写出反应的离子方程式。但是检验腐蚀废液中是否含有
能被酸性高锰酸钾溶液氧化而使高锰酸钾溶液褪色,请写出反应的离子方程式。但是检验腐蚀废液中是否含有 , 不能用酸性高锰酸钾溶液进行检验,原因是。
, 不能用酸性高锰酸钾溶液进行检验,原因是。
-
(6) 向
 溶液中加入
溶液中加入 溶液的实验现象为。
溶液的实验现象为。

下列说法错误的是( )
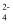 +3Cl-+10H+
D . iv 中反应说明溶解度:Na2FeO4>K2FeO4
+3Cl-+10H+
D . iv 中反应说明溶解度:Na2FeO4>K2FeO4
 、
、 的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断正确的是( )
的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断正确的是( )
 B . 溶液中一定含有
B . 溶液中一定含有 C . 溶液中一定含有
C . 溶液中一定含有 D . 剩余固体中一定含有
D . 剩余固体中一定含有
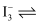 I2+I-
I2+I- 试纸测
试纸测  溶液和
溶液和  溶液的
溶液的 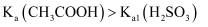
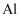 和
和  完全反应后固体,溶于足量稀硫酸,滴加
完全反应后固体,溶于足量稀硫酸,滴加 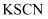 溶液
溶液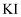 试纸放入含有红棕色气体的集气瓶中
试纸放入含有红棕色气体的集气瓶中 ,具有氧化性
,具有氧化性 加水溶解后,滴加稀硫酸酸化,再滴加
加水溶解后,滴加稀硫酸酸化,再滴加 


