高三化学上学期上册试题
常温下,下列各组离子一定能在指定溶液中大量共存的是 ( )
A.1.0mol·L-1的KNO3溶液中:Fe2+、H+、Cl-、I-
B.常温下,在c(H+)/c(OH-) = 1×1012的溶液:NH4+、Mg2+、C1-、K+
C.含大量Fe3+的溶液中:Na+、Mg2+、SO42-、SCN-
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
某溶液含有五种离子,且各离子物质的量浓度相等(不考虑水解与电离),已知其中三种离子为Na+、I—、NO3—,则另外两种离子可能是
A. Ba2+和OH— B. K+和AlO2— C. Fe3+和SO42— D. H+和Cl—
|

直接电解吸收是烟气脱硝的一种有效方法。用6%的稀硝酸吸收NOx会生成亚硝酸,再将吸收液导入
电解槽使之转化为硝酸。电解装置如下(阴、阳离子可通过隔膜,但分子不能通过):下列说法不正确的是( )
A.吸收NOx的过程涉及氧化还原反应
B.石墨电极为颗粒状,可增大接触面积,提高电解效率
C.当b极上产生2.8 L(标准状况)H2时,转移的电子数为0.5NA(设NA为阿伏加德罗常数的数值)
D.a极的电极反应式为HNO2-2e-+H2O===3H++NO![]()
.向等物质的量浓度的Ba(OH)2 与BaCl2 的混合溶液中加入NaHCO3 溶液,下列离子方程式与事实相符的是( )
A.HCO3-+OH- =CO32-+H2O B.Ba2++OH-+HCO3-=BaCO3↓+H2O
C.Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+H2O
D.2Ba2++3OH-+3HCO3-=2BaCO3↓+CO32-+3H2O
下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ① Fe(s) + CO2(g) | K1 | 1.47 | 2.15 |
| ② Fe(s) + H2O(g) | K2 | 2.38 | 1.67 |
| ③ CO(g) + H2O(g) | K3 | ? | ? |
则下列说法正确的是( )
A.ΔH 1<0,ΔH 2>0
B.反应①②③的反应热满足关系:ΔH 2-ΔH 1=ΔH 3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
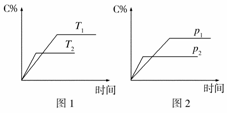
可逆反应A(?)+aB(g)![]() C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是 ( )
C(g)+2D(g)(a为正整数)。反应过程中,当其他条件不变时,C的百分含量(C%)与温度(T)和压强(p)的关系如图所示。下列说法不正确的是 ( )
A.若a=2,则A为液态或固体
B.该反应的正反应为放热反应
C.T2>T1,p2>p1
D.其他条件不变,增加B的物质的量,平衡正向
移动,平衡常数K增大
下列关于图所示原电池装置的叙述中,正确的是( )
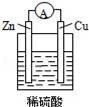

A.铜片是负极 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
.高分子H是人造棉的成分之一,其合成路线如下:
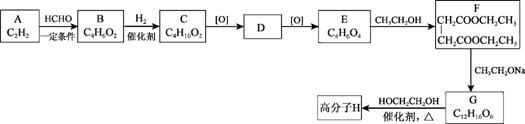
已知:Ⅰ.R1COOR2+R3CH2COOR4![]()
 +R2OH
+R2OH
Ⅱ.RCOOR’+R”OH![]() RCOOR”+R’OH
RCOOR”+R’OH
(R1、R2、R3、R4、R’、R”代表烃基)
(1)按官能团分类,A的类别是_______。
(2)B为不饱和醇,A→B的反应类型是_______。
(3)C的名称是_______。
(4)D的核磁共振氢谱显示其分子有2种不同环境的氢原子,D的结构简式是_______。
(5)E→F的化学方程式是_______。
(6)G分子内含有一个六元环(含“![]() ”结构)。
”结构)。
① 下列试剂能使![]() 转化为
转化为![]() 的是_______(填序号)。
的是_______(填序号)。
a.![]() b.
b.![]() c.
c.![]()
② G→H的反应类型为缩聚反应,该反应还有![]() 生成,其化学方程式是_______。
生成,其化学方程式是_______。
取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,下列物质不能满足上述结果的是 ( )
A.H2 B.CO C.C12H22O11 D.C6H12O6
铁、钴(Co)、镍(Ni)是同族元素,主要化合价均为+2、+3价,都是较活泼的金属,它们的化合物在工业上有重要的应用.
(1)配制FeSO4溶液时,需加入稀硫酸,其目的是_________________________
(2)写出CoCl2与氯水反应的化学方程式______________________________
(3) Co2+和Fe3+均可与KSCN溶液发生相似的反应,向CoCl2溶液中加入KSCN溶液,生成某种蓝色离子,该离子中钴元素的质量分数约为20%。则该离子的化学式为__________________。
(4)碳酸镍可用于电镀、陶瓷器着色等。镍矿渣中镍元素的主要存在形式是Ni(OH)2和NiS,从镍矿渣出发制备碳酸镍的反应如下:
先向镍矿渣中加入稀硫酸和NaClO3浸取出Ni2+,反应的离子方程式有①_____________________②NiS+ ClO3-+H+-Ni2++S+Cl-+H2O(未配平),此反应中还原产物与氧化产物的物质的量比为_________。再加入Na2CO3溶液沉镍,即制得碳酸镍,检验Ni2+是否沉淀完全的方法_____________________________________
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:
CuFeS2+4Fe3+===Cu2++5Fe2++2S
反应结束后,经处理获得单质硫x mol。下列说法正确的是( )
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x) mol![]()
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:
4CuI+Hg=Cu2HgI4+2Cu
(l)上述反应产物Cu2HgI4中,Cu元素是_______价:
(2)以上反应中的氧化剂为_______,当有1mol CuI参与反应时,转移电子_______mol;
(3) CuI可由Cu2+与I-直接反应制得,请配平下列反应的离子方程式.
____Cu2++ ____ I- --- ________CuI + _____I3-。
能正确表示下列反应的离子方程式是( )
A.将铜屑加入Fe3+溶液中:2Fe3++Cu=2Fe2++Cu2+
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.将氯化亚铁溶液和稀硝酸混合:Fe2++4H++NO3-=Fe3++2H2O+NO↑
D.将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
.某新型药物H( )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:

已知:(1)E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色
(2)![]() (R为烃基)
(R为烃基)
(3)![]()
请回答下列问题:
(1)A的结构简式为_____;D的官能团的名称为_____。
(2)①的反应类型是_____;④的反应条件是_____。
(3)写出B→C的化学方程式_____。
(4)写出F+G→H的化学方程式_____。
(5)参照H的上述合成路线,设计一条由乙醛和NH2CH(CH3)2为起始原料制备医药中间CH3CONHCH(CH3)2的合成路线_____。
已知:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol;
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g)△H=﹣226kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15, X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A. 原子半径:W>Z>Y>X>M
B. 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
C. XZ2, X2M2, W2Z2均为直线型的共价化合物
D. 由X元素形成的单质不一定是原子晶体
下列应用不涉及物质氧化性或还原性的是( )
A.用葡萄糖制镜或保温瓶胆 B.用ClO2杀菌、消毒
C.用Na2SiO3溶液制备木材防火剂 D.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
实验室提供下列仪器(用品)和药品:
仪器(用品):①铁架台(附铁圈、铁夹);②酸(碱)式滴定管;③烧杯;④玻璃棒;⑤胶头滴管;⑥天平(含砝码、镊子);⑦滤纸;⑧分液漏斗;⑨普通漏斗;⑩双孔橡皮塞;![]() 烧瓶
烧瓶
药品:碱石灰、Na2CO3固体,NH4C1固体、MnO2、标准NaOH溶液、未知浓度的HCl
溶液、H2O2溶液、蒸馏水。
请按要求填空:
(1)过滤时,应选用的仪器是 (请填写序号)。
(2)欲配制500m L0.1 mol/L的Na2CO3溶液,还缺少的仪器是 ;
若测定未知HCl溶液的浓度,还缺少的仪器是 。
(3)可用上述提供的药品和仪器来制取的气体是 (请填写化学式)。
纵观古今,化学与生活皆有着密切联系。下列有关说法错误的是( )
A. “梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花的相同
B. 制作烟花的过程中常加入金属发光剂和发色剂使烟花放出五彩缤纷的颜色
C. 草莓棚中使用的“吊袋式二氧化碳气肥”的主要成分可以是碳酸钙
D. 《本草纲目》记载的“凡酸坏之酒,皆可蒸烧”的实验方法可用来分离乙酸和乙醇
汽车尾气中的CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下:
NOO3反应ⅠNO2CO(NH2)2反应ⅡN2
①反应 Ⅰ 为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是___ mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为__。
(2)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO和NO,请写出生成等物质的量的NO和NO时的离子方程式:__。

(3)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的__ __(填“阳极”或“阴极”),同时在另一极生成S2O的电极反应式为__。
(4)已知进入装置Ⅳ的溶液中NO的浓度为a g·L-1,要使1 m3该溶液中的NO完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气__ L(用含a的代数式表示,结果保留整数)。



