й«ҳдёүеҢ–еӯҰдёҠеӯҰжңҹдёҠеҶҢиҜ•йўҳ
еҚ•иҙЁXдёҺжө“H2SO4е…ұзғӯпјҢеҸҚеә”дёӯXдёҺжө“H2SO4зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1:2пјҢеҲҷXе…ғзҙ еңЁз”ҹжҲҗзү©дёӯзҡ„еҢ–еҗҲд»·еҸҜиғҪдёәВ в‘ пјӢlВ В В в‘ЎпјӢ2В В В В в‘ўпјӢ3В В В в‘ЈпјӢ4
AпјҺв‘Ўв‘ЈВ В В В В В BпјҺв‘ўв‘ЈВ В В В В В CпјҺв‘ в‘ЎВ В В В В D. в‘ в‘ў
дәҡзЎқй…ёй’ҷ[Ca(NO2)2]жҳҜж°ҙжіҘж··еҮқеңҹеӨ–еҠ еүӮзҡ„дё»иҰҒеҺҹж–ҷпјҢжҹҗеӯҰд№ е°Ҹз»„и®ҫи®Ўе®һйӘҢеҲ¶еӨҮдәҡзЎқй…ёй’ҷпјҢе®һйӘҢиЈ…зҪ®еҰӮеӣҫжүҖзӨәпјҲеӨ№жҢҒиЈ…зҪ®з•ҘеҺ»пјүпјҡ

е·ІзҹҘпјҡ2NO+CaO2 =Ca(NO2)2пјӣ2NO2+CaO2=Ca(NO3)2гҖӮ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
(1)е°ҶеҲҶж¶ІжјҸж–—дёӯзҡ„зЁҖзЎқй…ёж»ҙе…ҘдёүйўҲзғ§з“¶дёӯзҡ„ж“ҚдҪңдёә______________гҖӮ
(2)еҗ‘дёүйўҲзғ§з“¶дёӯеҠ е…ҘзЁҖзЎқй…ёд№ӢеүҚпјҢеә”еҗ‘иЈ…зҪ®дёӯйҖҡе…ҘдёҖж®өж—¶й—ҙзҡ„N2пјҢеҺҹеӣ дёә_________________гҖӮВ В В В
(3)иЈ…зҪ®Dдёӯзҡ„д»ӘеҷЁеҗҚз§°дёә_______________гҖӮиЈ…зҪ®BжүҖеҠ иҜ•еүӮдёә_______________гҖӮ
(4)иЈ…зҪқFдёӯпјҢй…ёжҖ§K2Cr2O7жә¶ж¶ІеҸҜе°Ҷеү©дҪҷзҡ„NOж°§еҢ–дёәNO3-пјҢжә¶ж¶Із”ұж©ҷиүІеҸҳдёәз»ҝиүІ(Cr3+)пјҢеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә_________________гҖӮ
(5)е·ІзҹҘпјҡCa(NO2)2жә¶ж¶ІйҒҮй…ёдјҡдә§з”ҹNOж°”дҪ“гҖӮи®ҫи®Ўе®һйӘҢиҜҒжҳҺиЈ…зҪ®EдёӯжңүдәҡзЎқй…ёй’ҷз”ҹжҲҗпјҡ____________гҖӮ
(6)е·ҘдёҡдёҠеҸҜз”ЁзҹізҒ°д№іе’ҢзЎқй…ёе·Ҙдёҡзҡ„е°ҫж°”пјҲеҗ«NOгҖҒNO2)еҸҚеә”пјҢж—ўиғҪеҮҖеҢ–з©әж°”пјҢеҸҲиғҪиҺ·еҫ—еә”з”Ёе№ҝжіӣзҡ„ Ca(NO2)2пјҢеҸҚеә”еҺҹзҗҶдёәCa(OH)2 + NO+NO2=Ca(NO2)2 + H2OгҖӮ
в‘ иӢҘn(NO)пјҡn(NO2)>lпјҡlпјҢеҲҷдјҡеҜјиҮҙ_________________________________________________гҖӮ
в‘ЎиӢҘn(NO)пјҡn(NO2)<1пјҡ1пјҢеҲҷдјҡеҜјиҮҙ________________________________________________гҖӮ
з”ЁдёӢеҲ—е®һйӘҢиЈ…зҪ®иҝӣиЎҢзӣёеә”е®һйӘҢпјҢиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„зҡ„жҳҜгҖҗВ В В В гҖ‘

AпјҺз”Ёеӣҫз”ІжүҖзӨәиЈ…зҪ®еҸҜд»Ҙе°Ҷд№ҷйҶҮе’Ңж°ҙеҲҶзҰ»
BпјҺз”Ёеӣҫд№ҷжүҖзӨәиЈ…зҪ®и’ёеҸ‘зЎ«й…ёй“ңжә¶ж¶ІеҲ¶еӨҮзЎ«й…ёй“ңжҷ¶дҪ“
CпјҺз”ЁеӣҫдёҷжүҖзӨәиЈ…зҪ®йҖҡиҝҮзЁҖзЎқй…ёдёҺй“ҒеҸҚеә”еҲ¶еҸ–е°‘йҮҸзҡ„ж°ўж°”
DпјҺз”ЁеӣҫдёҒжүҖзӨәиЈ…зҪ®еҲҶзҰ»ж°ўж°§еҢ–й’ҷеӣәдҪ“дёӯж··жңүзҡ„е°‘йҮҸж°ҜеҢ–й“өеӣәдҪ“
еңЁ25в„ғгҖҒ101kPaж—¶пјӣCпјҲsпјүгҖҒH2пјҲgпјүгҖҒCH3COOHпјҲlпјүзҡ„зҮғзғ§зғӯеҲҶеҲ«дёә393.5kJВ·molпјҚ1гҖҒ285.8kJВ·molпјҚ1гҖҒ870.3kJВ·molпјҚ1пјҢеҲҷ2CпјҲsпјүпјӢ2H2пјҲgпјүпјӢO2пјҲgпјүпјқCH3COOHпјҲlпјүзҡ„еҸҚеә”зғӯдёә
AпјҺпјҚ488.3kJВ·molпјҚ1
BпјҺпјӢ488.3kJВ·molпјҚ1
CпјҺпјҚ191kJВ·molпјҚ1
DпјҺпјӢ191kJВ·molпјҚ1
NaClжҳҜдёҖз§ҚеҢ–е·ҘеҺҹж–ҷпјҢеҸҜд»ҘеҲ¶еӨҮдёҖзі»еҲ—зү©иҙЁпјҲеҰӮдёӢеӣҫжүҖзӨәпјүгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ(В В )

AпјҺз”ЁCl2еҲ¶еӨҮжјӮзҷҪзІүж—¶пјҢжҳҜе°ҶCl2йҖҡе…ҘеҲ°зҹізҒ°ж°ҙдёӯ
BпјҺз”ұж°ҜеҢ–й’ еҲ¶еӨҮзәҜзўұзҡ„иҝҮзЁӢдёӯпјҢеҲ©з”ЁдәҶзү©иҙЁжә¶и§ЈеәҰзҡ„е·®ејӮ
CпјҺеёёжё©дёӢе№ІзҮҘCl2иғҪ用钢瓶иҙ®иҝҗпјҢжүҖд»ҘCl2дёҚдёҺй“ҒеҸҚеә”
DпјҺеӣҫдёӯжүҖзӨәиҪ¬еҢ–еҸҚеә”йғҪжҳҜж°§еҢ–иҝҳеҺҹеҸҚеә”
еңЁдёҖз§Қй…ёжҖ§жә¶ж¶ІдёӯпјҢеҸҜиғҪеӯҳеңЁNO![]() гҖҒIпјҚгҖҒClпјҚгҖҒFe3пјӢдёӯзҡ„дёҖз§ҚжҲ–еҮ з§ҚзҰ»еӯҗпјҢеҗ‘иҜҘжә¶ж¶ІдёӯеҠ е…Ҙжәҙж°ҙпјҢжәҙеҚ•иҙЁиў«иҝҳеҺҹпјҢеҲҷд»ҘдёӢжҺЁжөӢдёӯдёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
гҖҒIпјҚгҖҒClпјҚгҖҒFe3пјӢдёӯзҡ„дёҖз§ҚжҲ–еҮ з§ҚзҰ»еӯҗпјҢеҗ‘иҜҘжә¶ж¶ІдёӯеҠ е…Ҙжәҙж°ҙпјҢжәҙеҚ•иҙЁиў«иҝҳеҺҹпјҢеҲҷд»ҘдёӢжҺЁжөӢдёӯдёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
AпјҺдёҖе®ҡжңүзўҳзҰ»еӯҗгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В В В BпјҺеҸҜиғҪеҗ«й“ҒзҰ»еӯҗ
CпјҺеҸҜиғҪжңүж°ҜзҰ»еӯҗВ В В В В В В В В В В В В В В DпјҺдёҚеҗ«зЎқй…ёж №зҰ»еӯҗ
зўҳеҫӘзҺҜе·ҘиүәдёҚд»…иғҪеҗёж”¶SO2йҷҚдҪҺзҺҜеўғжұЎжҹ“пјҢеҗҢж—¶еҸҲиғҪеҲ¶еҫ—ж°ўж°”пјҢе…·дҪ“жөҒзЁӢеҰӮдёӢпјҡ

дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
A. еҲҶзҰ»еҷЁдёӯзҡ„зү©иҙЁеҲҶзҰ»ж“ҚдҪңдёәиҝҮж»Ө
B. иҶңеҸҚеә”еҷЁдёӯпјҢеўһеӨ§еҺӢејәжңүеҲ©дәҺжҸҗй«ҳйҖҹзҺҮе’ҢHIзҡ„е№іиЎЎиҪ¬еҢ–зҺҮ
C. иҜҘе·ҘиүәдёӯI2е’ҢHIзҡ„зӣёдә’иҪ¬еҢ–дҪ“зҺ°дәҶвҖңзўҳеҫӘзҺҜвҖқ
D. зўҳеҫӘзҺҜе·Ҙиүәзҡ„жҖ»еҸҚеә”дёә2SO2пјӢ4H2OпјӢI2![]() H2 + 2H2SO4 +2HI
H2 + 2H2SO4 +2HI
жҠҠ27 g AlзІүе’ҢдёҖе®ҡйҮҸзҡ„Fe3O4зІүж··еҗҲеқҮеҢҖпјҢй…ҚжҲҗй“қзғӯеүӮпјҢеҲҶжҲҗдёӨзӯүд»ҪгҖӮ
пјҲ1пјүеүҚдёҖд»ҪеңЁй«ҳжё©дёӢжҒ°еҘҪе®Ңе…ЁеҸҚеә”пјҢдё”иғҪж”ҫеҮә207.54kJзғӯйҮҸпјҢеҶҷеҮәжӯӨеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
пјҲ2пјүе°ҶеүҚдёҖд»ҪжүҖеҫ—зҡ„з”ҹжҲҗзү©дёҺи¶ійҮҸзҡ„зӣҗй…ёе……еҲҶеҸҚеә”пјӣеҗҺдёҖд»ҪзӣҙжҺҘеҠ е…Ҙи¶ійҮҸзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІдҪҝд№Ӣе……еҲҶеҸҚеә”гҖӮеүҚеҗҺдёӨз§Қжғ…еҶөдёӢз”ҹжҲҗж°”дҪ“зҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёәВ В В В В В В В В В В В В В гҖӮ
жҹҗж ‘и„Ӯзҡ„еҗҲжҲҗзәҝи·ҜеҰӮдёӢпјҡ
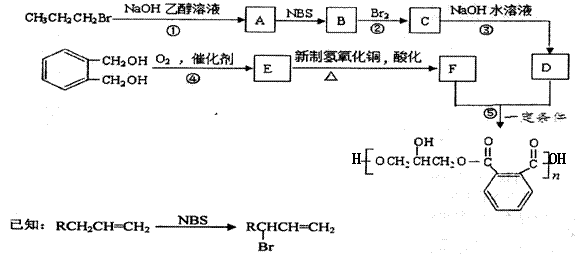 В
В
В В пјҲ1пјүBдёӯеҗ«жңүзҡ„е®ҳиғҪеӣўзҡ„еҗҚз§°жҳҜ________________________гҖӮВ В
пјҲ2пјүеҸҚеә”в‘ гҖҒв‘ўзҡ„жңүжңәеҸҚеә”зұ»еһӢеҲҶеҲ«жҳҜ________________гҖҒ____________________гҖӮ
пјҲ3пјүжЈҖйӘҢCH3CH2CH2Brдёӯзҡ„жәҙеҺҹеӯҗж—¶пјҢжүҖеҠ иҜ•еүӮзҡ„йЎәеәҸдҫқж¬ЎжҳҜВ В В В В В В В В В В В В В гҖӮ
пјҲ4пјүдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ__________пјҲеЎ«еӯ—жҜҚзј–еҸ·пјүгҖӮ
aпјҺ1 mol EдёҺи¶ійҮҸзҡ„银氨жә¶ж¶ІеҸҚеә”иғҪз”ҹжҲҗ2mol AgВ В В
bпјҺеҸҜд»Ҙз”ЁNaHCO3йүҙеҲ«Eе’ҢFВ В В В
cпјҺBеҲҶеӯҗеӯҳеңЁйЎәеҸҚејӮжһ„
В В пјҲ5пјүеҶҷеҮәеҸҚеә”в‘Өзҡ„еҢ–еӯҰж–№зЁӢејҸ______________________________________________гҖӮ
В В пјҲ6пјү![]() зҡ„еҗҢеҲҶејӮжһ„дҪ“дёӯеҗҢж—¶з¬ҰеҗҲдёӢеҲ—жқЎд»¶зҡ„иҠійҰҷж—ҸеҢ–еҗҲзү©е…ұжңү______з§ҚпјҢе…¶дёӯиӢҜзҺҜдёҠдёҖж°Ҝд»Јзү©жңүдёӨз§Қзҡ„з»“жһ„з®ҖејҸдёәВ В В В В В В В В В В В В В В В В В В В В В гҖӮ
зҡ„еҗҢеҲҶејӮжһ„дҪ“дёӯеҗҢж—¶з¬ҰеҗҲдёӢеҲ—жқЎд»¶зҡ„иҠійҰҷж—ҸеҢ–еҗҲзү©е…ұжңү______з§ҚпјҢе…¶дёӯиӢҜзҺҜдёҠдёҖж°Ҝд»Јзү©жңүдёӨз§Қзҡ„з»“жһ„з®ҖејҸдёәВ В В В В В В В В В В В В В В В В В В В В В гҖӮ
В В В aпјҺиғҪеҸ‘з”ҹж¶ҲеҺ»еҸҚеә”В В В В В В В В В В bпјҺиғҪдёҺиҝҮйҮҸжө“жәҙж°ҙеҸҚеә”з”ҹжҲҗзҷҪиүІжІүж·Җ
В е·ІзҹҘиӢҜд№ҷзғҜзҡ„з»“жһ„дёә![]() гҖӮжңүе…іиҜҘзү©иҙЁзҡ„дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
гҖӮжңүе…іиҜҘзү©иҙЁзҡ„дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
AпјҺиҜҘзү©иҙЁеңЁдёҖе®ҡжқЎд»¶дёӢе’Ңж°ўж°”е®Ңе…ЁеҠ жҲҗпјҢеҠ жҲҗдә§зү©зҡ„дёҖжәҙеҸ–д»Јзү© 6 з§Қ
BпјҺиҜҘзү©иҙЁиғҪдҪҝжәҙж°ҙе’Ңй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІпјҢиӨӘиүІеҺҹзҗҶе®Ңе…ЁзӣёеҗҢ
CпјҺиӢҜд№ҷзғҜеҲҶеӯҗзҡ„жүҖжңүеҺҹеӯҗдёҚеҸҜиғҪеңЁеҗҢдёҖе№ійқўдёҠ
DпјҺйҷӨеҺ»д№ҷиӢҜдёӯж··жңүзҡ„иӢҜд№ҷзғҜеҸҜд»ҘйҖҡе…ҘзӯүйҮҸж°ўж°”еҸҚеә”
е®һйӘҢе®Өеёёз”Ё98%(ПҒпјқ1.84 gВ·mLпјҚ1)зҡ„жө“H2SO4й…ҚеҲ¶1вҲ¶4 зҡ„зЁҖH2SO4пјҢжӯӨзЁҖH2SO4зҡ„еҜҶеәҰдёә1.23 gВ·mLпјҚ1пјҢе…¶зү©иҙЁзҡ„йҮҸжө“еәҰдёә(гҖҖгҖҖ)
AпјҺ4.6 molВ·LпјҚ1В В В В BпјҺ5.7 molВ·LпјҚ1В В В В В В В
CпјҺ3.88 molВ·LпјҚ1В В В DпјҺ18.4 molВ·LпјҚ1
иӢҘз”ЁAGиЎЁзӨәжә¶ж¶Ізҡ„й…ёеәҰпјҢе…¶иЎЁиҫҫејҸдёәAG=![]() е®Өжё©дёӢпјҢе®һйӘҢе®ӨйҮҢз”Ё0.1mol/Lзҡ„зӣҗй…ёж»ҙе®ҡ10mL0.1mol/LMOHжә¶ж¶ІпјҢж»ҙе®ҡжӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
е®Өжё©дёӢпјҢе®һйӘҢе®ӨйҮҢз”Ё0.1mol/Lзҡ„зӣҗй…ёж»ҙе®ҡ10mL0.1mol/LMOHжә¶ж¶ІпјҢж»ҙе®ҡжӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
A.иҜҘж»ҙе®ҡиҝҮзЁӢеҸҜйҖүжӢ©й…ҡй…һдҪңдёәжҢҮзӨәеүӮ
B.иӢҘBзӮ№еҠ е…Ҙзҡ„зӣҗй…ёдҪ“з§Ҝдёә5mL,жүҖеҫ—жә¶ж¶Ідёӯ:c(M+)+2c(H+)=c(MOH)+2c(OH-)
C.ж°ҙзҡ„з”өзҰ»зЁӢеәҰ:A<D<C
D.MOHзҡ„з”өзҰ»е№іиЎЎеёёж•°дёә1Г—10-17
ж №жҚ®д»ҘдёӢ3дёӘзғӯеҢ–еӯҰж–№зЁӢејҸ:
2H2S(g)+3O2(g)= 2SO2(g)+2H2O(l)В В в–іH= Q1 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(l)В В в–іH= Q2 kJ/mol
2H2S(g)+O2(g)=2S (s)+2H2O(g)В В в–іH= Q3 kJ/mol
еҲӨж–ӯQ1гҖҒQ2гҖҒQ3дёүиҖ…е…ізі»жӯЈзЎ®зҡ„жҳҜ
A. Q3 >Q2>Q1В В В B. Q1>Q2>Q3В В В C. Q1>Q3>Q2В В В D. Q2>Q1>Q3
жңүе…ізўұйҮ‘еұһзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖ гҖҖ)
AпјҺйҡҸж ёз”өиҚ·ж•°зҡ„еўһеҠ пјҢзўұйҮ‘еұһеҚ•иҙЁзҡ„зҶ”зӮ№йҖҗжёҗйҷҚдҪҺпјҢеҜҶеәҰйҖҗжёҗеўһеӨ§
BпјҺзўұйҮ‘еұһеҚ•иҙЁзҡ„йҮ‘еұһжҖ§еҫҲејәпјҢеқҮжҳ“дёҺж°Ҝж°”гҖҒж°§ж°”гҖҒж°®ж°”зӯүеҸ‘з”ҹеҸҚеә”
CпјҺзўій…ёй“ҜеҠ зғӯж—¶дёҚиғҪеҲҶи§ЈдёәдәҢж°§еҢ–зўіе’Ңж°§еҢ–й“Ҝ
DпјҺж— ж°ҙзЎ«й…ёй“Ҝзҡ„еҢ–еӯҰејҸдёәCs2SO4пјҢе®ғдёҚжҳ“жә¶дәҺж°ҙ
 дёӢеӣҫеҗ„зү©иҙЁеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜеҸ‘з”ҹеҰӮеӣҫжүҖзӨәзҡ„иҪ¬еҢ–е…ізі»гҖӮе·ІзҹҘпјҡAгҖҒBйғҪдёәзғғпјҢе…¶дёӯBзҡ„дә§йҮҸжҳҜиЎЎйҮҸдёҖдёӘеӣҪ家еҢ–е·Ҙз”ҹдә§ж°ҙе№ізҡ„ж Үеҝ—пјҢAиҪ¬еҢ–дёәCзҡ„иҝҮзЁӢдёӯеҺҹеӯҗеҲ©з”ЁзҺҮдёәзҷҫеҲҶд№ӢзҷҫгҖӮ
дёӢеӣҫеҗ„зү©иҙЁеңЁдёҖе®ҡжқЎд»¶дёӢеҸҜеҸ‘з”ҹеҰӮеӣҫжүҖзӨәзҡ„иҪ¬еҢ–е…ізі»гҖӮе·ІзҹҘпјҡAгҖҒBйғҪдёәзғғпјҢе…¶дёӯBзҡ„дә§йҮҸжҳҜиЎЎйҮҸдёҖдёӘеӣҪ家еҢ–е·Ҙз”ҹдә§ж°ҙе№ізҡ„ж Үеҝ—пјҢAиҪ¬еҢ–дёәCзҡ„иҝҮзЁӢдёӯеҺҹеӯҗеҲ©з”ЁзҺҮдёәзҷҫеҲҶд№ӢзҷҫгҖӮ
пјҲ1пјүеҶҷеҮәCзҡ„з»“жһ„з®ҖејҸ в–І![]()
пјҲ2пјүеҶҷеҮәDе’Ңз”ІйҶҮз”ҹжҲҗFзҡ„ж–№зЁӢејҸ в–І![]()
пјҲ3пјүдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ в–І![]()
A.В В зү©иҙЁAгҖҒBеҸҜд»Ҙз”Ёй…ёжҖ§й«ҳй”°й…ёй’ҫйүҙеҲ«
B.В В зү©иҙЁCгҖҒDдә’дёәеҗҢеҲҶејӮжһ„дҪ“
C.В В зү©иҙЁBдёӯжүҖжңүеҺҹеӯҗйғҪеңЁеҗҢдёҖе№ійқўеҶ…
D.В В зү©иҙЁEз”ҹжҲҗFзҡ„еҸҚеә”еұһдәҺеҠ жҲҗеҸҚеә”пјҢд№ҹеұһдәҺиҝҳеҺҹеҸҚеә”
дёӢеҲ—иҜҙжі•дёӯдёҚжӯЈзЎ®зҡ„жҳҜВ В В
A.зЎ…дё»иҰҒд»ҘеҚ•иҙЁгҖҒж°§еҢ–зү©гҖҒзЎ…й…ёзӣҗзҡ„еҪўејҸеӯҳеңЁдәҺиҮӘ然з•Ңдёӯ
B.йҖӮйҮҸCO2йҖҡе…ҘжјӮзҷҪзІүзҡ„ж°ҙжә¶ж¶ІеҸҜд»Ҙз”ҹжҲҗзҷҪиүІжІүж·Җ
C.еңЁзҮғз…ӨдёӯеҠ дәәзҹізҒ°зҹіеҸҜеҮҸе°‘SO2зҡ„жҺ’ж”ҫпјҢеҸ‘з”ҹзҡ„жҖ»еҸҚеә”дёә2CaCO3+2SO2+O2![]() 2CO2+2CaSO4
2CO2+2CaSO4
D.дёҚиғҪз”ЁзҺ»з’ғ瓶жқҘзӣӣиЈ…ж°ҹеҢ–й’ ж°ҙжә¶ж¶І
дёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ
в‘ PH=0зҡ„жә¶ж¶ІпјҡNa+гҖҒCl-гҖҒ MnO4-гҖҒSO42-
в‘ЎpH=l1зҡ„жә¶ж¶ІдёӯпјҡCO32-гҖҒNa+гҖҒAlO2-гҖҒNO3-гҖҒS2-гҖҒSO32-
в‘ўж°ҙз”өзҰ»зҡ„H+жө“еәҰc(H+)=l0-12molВ·L-1зҡ„жә¶ж¶ІдёӯпјҢCl-гҖҒCO32-гҖҒNO3-гҖҒNH4+гҖҒSO32-
в‘ЈеҠ е…Ҙ Mg иғҪж”ҫеҮәH2зҡ„жә¶ж¶ІдёӯпјҡMg2+гҖҒNH4+гҖҒCl-гҖҒK+гҖҒSO42-
в‘ӨдҪҝзҹіи•ҠеҸҳзәўзҡ„жә¶ж¶ІдёӯпјҡFe2+гҖҒMnO4-гҖҒNO3-гҖҒNa+гҖҒNa+гҖҒSO42-
в‘ҘдёӯжҖ§жә¶ж¶ІдёӯпјҡFe3+гҖҒAl3+гҖҒNO3-гҖҒI-гҖҒCl-гҖҒS2-
A.в‘Ўв‘ЈВ В В В B.в‘ в‘ўв‘ҘВ В В C.в‘ в‘Ўв‘Ө D.в‘ в‘Ўв‘Ҙ
дёӢеҲ—е®һйӘҢи®ҫи®ЎеҸҠе…¶еҜ№еә”зҡ„зҰ»еӯҗж–№зЁӢејҸеқҮжӯЈзЎ®зҡ„жҳҜ (В В В В В В В В В В В В В В В )
AпјҺж°ўж°§еҢ–й“Ғжә¶дәҺж°ўзўҳй…ёпјҡFe(OH)3 +3H+ В пјқFe3++3H2O
BпјҺNa2O2 дёҺВ H2O еҸҚеә”еҲ¶еӨҮВ O2пјҡNa2O2пјӢH2O===2NaпјӢпјӢ2OHпјҚпјӢO2вҶ‘ CпјҺе°Ҷж°Ҝж°”жә¶дәҺж°ҙеҲ¶еӨҮж¬Ўж°Ҝй…ёпјҡCl2пјӢH2O===2HпјӢпјӢClпјҚпјӢClOпјҚ
DпјҺеҗ‘ Ba(OH)2 жә¶ж¶Ідёӯж»ҙеҠ H2SO4 жә¶ж¶ІпјҡBa2пјӢпјӢ2OHпјҚпјӢ2HпјӢпјӢSO2-пјқBaSO4вҶ“пјӢ2H2O
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWеҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§пјҢXзҡ„жҹҗз§ҚеҚ•иҙЁжҳҜдёҖз§ҚзІ®д»“дёӯеёёз”Ёзҡ„зІ®йЈҹдҝқжҠӨж°”пјҢYе’ҢZеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°д№Ӣе’ҢзӯүдәҺWеҺҹеӯҗзҡ„жңҖеӨ–еұӮз”өеӯҗж•°пјҢZеҺҹеӯҗж ёеӨ–з”өеӯҗж•°жҳҜWеҺҹеӯҗжңҖеӨ–еұӮз”өеӯҗж•°зҡ„2еҖҚгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҲВ пјү
В AпјҺеҺҹеӯҗеҚҠеҫ„пјҡr(Y) <r(X) <r(W) <r(Z)
В BпјҺе…ғзҙ Zзҡ„жңҖй«ҳд»·еҗ«ж°§й…ёзҡ„й…ёжҖ§жҜ”Wзҡ„ејә
В CпјҺе…ғзҙ YгҖҒWзҡ„зҰ»еӯҗе…·жңүзӣёеҗҢзҡ„з”өеӯҗеұӮз»“жһ„
В DпјҺZзҡ„з®ҖеҚ•ж°”жҖҒж°ўеҢ–зү©зҡ„зғӯзЁіе®ҡжҖ§жҜ”Wзҡ„ејұ
жҹҗеҢ–еӯҰе®һйӘҢе°Ҹз»„еҗҢеӯҰдёәдәҶиҜҒжҳҺгҖҒжҜ”иҫғSO2е’Ңж°Ҝж°ҙзҡ„жјӮзҷҪжҖ§пјҢи®ҫи®ЎдәҶеҰӮдёӢеӣҫжүҖзӨәзҡ„е®һйӘҢиЈ…зҪ®гҖӮ
В

(1) е®һйӘҢе®ӨеёёйҖүз”ЁеҲ¶CO2зҡ„еҸ‘з”ҹиЈ…зҪ®еҲ¶SO2пјӣе®һйӘҢе®ӨеңЁз”ЁMnO2и·ҹжө“зӣҗй…ёеҸҚеә”еҲ¶еӨҮCl2ж—¶пјҢеә”йҖүз”ЁдёҠеӣҫAгҖҒEдёӨеҸ‘з”ҹиЈ…зҪ®дёӯВ В В иЈ…зҪ®(еЎ«иЈ…зҪ®еәҸеҸ·)еҲ¶Cl2гҖӮ
В (2) еҸҚеә”ејҖе§ӢеҗҺпјҢеҸ‘зҺ°BгҖҒDдёӨдёӘиҜ•з®Ўдёӯзҡ„е“Ғзәўжә¶ж¶ІйғҪиӨӘеҺ»пјҢеҒңжӯўйҖҡж°”еҗҺпјҢз»ҷBгҖҒDдёӨдёӘиҜ•з®ЎеҠ зғӯпјҢдёӨдёӘиҜ•з®Ўдёӯзҡ„зҺ°иұЎеҲҶеҲ«дёәBпјҡВ В гҖҖгҖҖВ пјҢDпјҡВ гҖҖгҖҖВ В В гҖӮ
В (3) иЈ…зҪ®Cзҡ„дҪңз”ЁжҳҜВ В В гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ гҖӮ
В (4) з”Ід№ҷдёӨеҗҚеҗҢеӯҰеҲҶеҲ«еҲ©з”ЁдёӢеӣҫжүҖзӨәиЈ…зҪ®жҺўз©¶дёӨз§Қж°”дҪ“жҢүдёҚеҗҢжҜ”дҫӢж··еҗҲеҗҺзҡ„жјӮзҷҪжҖ§гҖӮиҜ•еҲҶжһҗпјҡ

в‘ еңЁж°”дҪ“иҝӣе…Ҙе“Ғзәўжә¶ж¶Ід№ӢеүҚпјҢе…Ҳе°ҶSO2е’ҢCl2йҖҡиҝҮзӣӣжңүжө“зЎ«й…ёиЈ…зҪ®зҡ„зӣ®зҡ„жҳҜпјҡ
В В гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖ гҖӮ
в‘Ўз”ІеҗҢеӯҰеңЁе®һйӘҢиҝҮзЁӢдёӯеҸ‘зҺ°пјҡйҖҡж°”дёҖж®өж—¶й—ҙеҗҺпјҢе“Ғзәўжә¶ж¶ІеҮ д№ҺдёҚиӨӘиүІпјҢе…¶еҺҹеӣ жҳҜпјҡВ В гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ пјҢ并еҶҷеҮәе…¶зӣёеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡВ В гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В гҖӮ
в‘ўд№ҷеҗҢеӯҰеңЁе®һйӘҢиҝҮзЁӢдёӯеҸ‘зҺ°пјҡйҖҡж°”дёҖж®өж—¶й—ҙеҗҺпјҢе“Ғзәўжә¶ж¶ІйўңиүІйҡҸж—¶й—ҙжҺЁз§»еҸҳеҫ—и¶ҠжқҘи¶Ҡжө…пјҢ
е…¶еҺҹеӣ жҳҜпјҡ гҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖгҖҖВ В гҖӮ



